Enzim (part2)
Selasa, 24 Januari 2012 | Ayun
| Laporan Praktikum Biokimia Umum | Hari/tanggal : Selasa/30 November 2010 Waktu : 08.00 – 11.00 WIB PJP : Waras Nurcholis, M. Si Asisten : Syaefudin
|
ENZIM 2
KELOMPOK 10
Randi Hadianta (G34090020)
Yovita Sari (G34090028)
Kurrataa’yun (G34090105)
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
2010
PENDAHULUAN
Enzim dikatakan sebagai suatu kelompok protein yang berperan dalam aktivitas biologis. Enzim ini berfungsi sebagai katalisator dalam sel dan sifatnya sangat khas. Dalam jumlah yang sangat kecil, enzim dapat mengatur reaksi tertentu sehingga dalam keadaan normal tidak terjadi penyimpangan hasil reaksinya. Enzim akan kehilangan aktivitasnya karena panas, asam dan basa kuat, pelarut organik atau apa saja yang bisa menyebabkan denaturasi protein. Enzim dinyatakan mempunyai sifat yang sangat khas karena hanya bekerja pada substrat tertentu (Aisjah 1986).
Dalam mempelajari mengenai enzim, dikenal beberapa istilah diantaranya holoenzim, apoenzim, kofaktor, gugus prostetik, koenzim, dan substrat. Apoenzim adalah suatu enzim yang seluruhnya terdiri dari protein, sedangkan holoenzim adalah enzim yang mengandung gugus protein dan gugus non protein. Gugus yang bukan protein tadi dikenal dengan istilah kofaktor. Pada kofaktor ada yang terikat kuat pada protein dan sukar terurai dalam larutan yang disebut gugus prostetik dan adapula yang tidak terikat kuat pada protein sehingga mudah terurai yang disebut koenzim. Baik gugus prostetik maupun koenzim, keduanya merupakan bagian yang memungkinkan enzim bekerja pada substrat. Substrat merupakan zat-zat yang diubah atau direaksikan oleh enzim (Poedjiadi 2006).
Fungsi penting dari enzim adalah sebagai biokatalisator, reaksi kimia secara kolektif membentuk metabolisme perantara sel, suatu bagian yang sangat kecil dari suatu molekul besar protein enzim sangat berperan untuk katalis reaksi. Bagian yang kecil ini dinamakan bagian aktif enzim. Aktivitas katalik enzim dapat ditentukan juga melalui struktur tiga dimensi molekul enzim tersebut. Enzim disini mempunyai peranan katalis dalam menurunkan aktivitas dari reaksi energi. Aktivasi dapat diartikan sebagai sejumlah energi atau kalori yang diturunkan oleh suatu mol zat pada temperatur tertentu untuk membawa molekul kedalam aktifnya atau keadaan aktifnya, menurunkan energi aktivasi, mempercepat reaksi pada suhu dan tekanan tetap tanpa mengubah besarnya tetapan seimbangnya, dan mengendalikan reaksi (Wirahadikusuma 1989).
Enzim memegang peranan penting dalam berbagai reaksi dalam sel. Sebagai protein, enzim diproduksi dan digunakan oleh sel hidup untuk mengkatalisis reaksi seperti konversi energi dan metabolisme pertahanan sel. Enzim amilase memiliki kemampuan untuk memecah molekul-molekul pati dan glikogen. Molekul pati yang merupakan polimer dari alfa-D-glikopiranosa akan dipecah oleh enzim pada ikatan alfa-1,4- dan alfa-1,6-glikosida (Hart 2003).
Enzim amilase dapat diperoleh dari sekresi air liur atau saliva. Saliva adalah suatu cairan oral yang kompleks dan tidak berwarna yang terdiri atas campuran sekresi dari kelenjar ludah besar dan kecil yang ada pada mukosa oral. Saliva dapat disebut juga kelenjar ludah atau kelenjar air liur. Semua kelenjar ludah mempunyai fungsi untuk membantu mencerna makanan dengan mengeluarkan suatu sekret yang disebut “saliva” (ludah atau air liur). Pembentukan kelenjar ludah dimulai pada awal kehidupan fetus (4 - 12 minggu) sebagai invaginasi epitel mulut yang akan berdiferensiasi ke dalam duktus dan jaringan asinar. Enzim amilase di dalam tubuh manusia sangat penting. Enzim amilase ikut bertanggung jawab menjaga kesehatan dan proses metabolisme di dalam tubuh. Kekurangan enzim amilase dapat menyebabkan tubuh mengalami gangguan pencernaan (maladigesti), yang selanjutnya menyebabkan gangguan penyerapan (malabsorpsi).
Saliva merupakan cairan mulut yang kompleks terdiri dari campuran sekresi kelenjar saliva mayor dan minor yang ada dalam rongga mulut. Saliva sebagian besar yaitu sekitar 90 persennya dihasilkan saat makan yang merupakan reaksi atas rangsangan yang berupa pengecapan dan pengunyahan makanan (Kidd 1992).
Saliva terdapat sebagai lapisan setebal 0,1-0,01 mm yang melapisi seluruh jaringan rongga mulut. Pengeluaran air ludah pada orang dewasa berkisar antara 0,3-0,4 ml/menit sedangkan apabila distimulasi, banyaknya air ludah normal adalah 1-2 ml/menit. Menurunnya pH air ludah (kapasitas dapar / asam) dan jumlah air ludah yang kurang menunjukkan adanya resiko terjadinya karies yang tinggi. Meningkatnya pH air ludah (basa) akan mengakibatkan pembentukan karang gigi. Saliva memiliki beberapa fungsi, yaitu melicinkan dan membasahi rongga mulut sehingga membantu proses mengunyah dan menelan makanan, membasahi dan melembutkan makanan menjadi bahan setengah cair ataupun cair sehingga mudah ditelan dan dirasakan, membersihkan rongga mulut dari sisa-sisa makanan dan kuman, mempunyai aktivitas antibacterial dan sistem buffer, membantu proses pencernaan makanan melalui aktivitas enzim ptyalin (amilase ludah) dan lipase ludah, perpartisipasi dalam proses pembekuan dan penyembuhan luka karena terdapat faktor pembekuan darah dan epidermal growth factor pada saliva, jumlah sekresi air ludah dapat dipakai sebagai ukuran tentang keseimbangan air dalam tubuh dan membantu dalam berbicara (pelumasan pada pipi dan lidah) (Suharsono 1986).
Setiap hari sekitar 1-1.5 liter saliva dikeluarkan oleh kelenjar saliva. Saliva terdiri atas 99.24% air dan 0.58% terdiri atas ion-ion Ca2+, Mg2+, Na+, K+, PO43-, Cl-, HCO3-, SO42-, dan zat-zat organik seperti musin dan enzim amilase (ptialin). Saliva bersifat agak sedikit asam. Saliva mempunyai pH antara 5.75 sampai 7.05. Pada umumnya pH saliva adalah sedikit dibawah 7 (Aisjah 1986)
TUJUAN
Percobaan ini bertujuan untuk mengetahui sifat dan susunan air liur, pengaruh pH pada aktifitas amilase air liur, serta mengetahui hidrolisis pati matang dan mentah oleh amilase air liur.
ALAT DAN BAHAN
Alat-alat yang digunakan dalam praktikum ini adalah tabung reaksi, gelas piala, pipet tetes, pipet volumetrik 5 mL, penangas air, kertas saring, karet penyumbat, tabung erlenmeyer, glass wool dan corong.
Bahan praktikum yang digunakan adalah air saliva, kertas lakmus, kanji 1%, asam asetat, akuades, Na-Karbonat 0,1%, pereaksi iod, pereaksi Benedict, dan pH indikator.
PROSEDUR PERCOBAAN
Percobaan pertama dilakukan uji pengaruh pH pada aktifitas amilase air liur. Langkah pertama empat tabung reaksi disiapkan. Tabung pertama diisi dengan 2 ml HCl, tabung kedua diisi dengan 2 ml asam asetat, tabung ketiga diisi dengan 2 ml akuades, dan tabung keempat diisi dengan 2 ml Na2CO3 1%. Masing-masing tabung ditambah dengan 2 ml larutan kanji 1%, dan 2 ml air liur. Keempat tabung dikocok dengan baik dan diletakkan pada penangas air bersuhu 37°C selama 15 menit. Selanjutnya keempat larutan yang telah dipanaskan dibagi menjadi masing-masing dua tabung. Setiap larutan dilakukan uji Benedict dan uji Iod.
Percobaan kedua dilakukan hidrolisis pati matang oleh amilase air liur. Pada tabung diisi 3 ml larutan kanji 1% dan air liur yang telah disaring sebanyak 0,2 mL. Larutan tersebut dikocok dan dimasukkan ke penangas air bersuhu 37°C. Setiap 1 menit dilakukan uji iod dengan memasukkan 1 tetes larutan tersebut ke porselen dan direaksikan dengan larutan iod encer. Perbedaan warna yang timbul pada setiap menit dicatat. Ketika hasil uji Iod tidak menghasilkan reaksi positif lagi (titik akhromatik) larutan diuji dengan pereaksi benedict.
Percobaan ketiga dilakukan hidrolisis pati mentah oleh amilase air liur. Percobaan ini dilakukan dengan memasukkan tepung pati secukupnya ke dalam tabung reaksi dan dicampurkan 5mL akuades. Larutan tersebut dikocok dan ditambahkan 10 tetes saliva. Setelah bercampur, larutan dipanaskan dengan penangas air pada suhu 37oC selama 20 menit. Selanjutnya larutan disaring dengan kertas saring dan diambil filtratnya. Filtratnya dilakukan uji terhadap produksi hidrolisis pati oleh amilase seperti percobaan kedua. Perbedaan warna yang ditimbulkan saat uji Iod diamati setiap menit. Setelah diuji dengan iodium tidak bereaksi positif lagi, yaitu menjadi warna kuning (tidak ada perubahan warna atau adanya titik akromatik), larutan diuji dengan pereaksi Benedict. Kemudian hasilnya dibandingkan.
HASIL PENGAMATAN
Tabel 1. Pengaruh pH pada aktivitas enzim amilase
| Tabung ke- | pH | Uji Iod | Uji Benedict |
| 1 | 1 | Hitam (+) | Biru kehijauan (-) |
| 2 | 5 | Kuning muda (-) | Kuning (++) |
| 3 | 7 | Bening keunguan (+) | Kuning hijau (+) |
| 4 | 9 | Bening keunguan (+) | Kuning hijau (+) |
 Gambar 1. Uji Iod pada pH berbeda.
Gambar 1. Uji Iod pada pH berbeda.

Tabel 2. Hidrolisis pati oleh enzim amilase air liur
| Menit ke- | Uji Iod | Uji Benedict |
| 1 | Ungu | Hijau |
| 2 | Ungu | Hijau kebiruan |
| 3 | Ungu | Hijau kebiruan |
| 4 | Ungu | Hijau kebiruan |
| 5 | Ungu | Biru kuning |
| 6 | Biru pekat | - |
| 7 | Biru | - |
| 8 | Biru | - |
| 9 | Biru cerah | - |
| 10 | Biru cerah | - |
| 11 | Biru cerah | - |
| 12 | Biru cerah | - |
| 13 | Biru cerah | - |
| 14 | Biru cerah | - |
| 15 | Biru kemerahan | - |
| 16 | Biru kemerahan | - |
| 17 | Biru kemerahan | - |
| 18 | Biru kemerahan | - |
| 19 | Kuning | - |
| 20 | Kuning | - |
| 21 | Kuning agak tua | - |
| 22 | Kuning kecokelatan | - |

Gambar 4. Uji Benedict pada menit ke-5
Tabel 3. Hidrolisis pati mentah oleh enzim amilase pada air liur
| Menit ke- | Uji Iod | Uji Benedict |
| 1 | Ungu | Hijau |
| 2 | Ungu | Hijau kebiruan |
| 3 | Biru | Hijau kebiruan |
| 4 | Biru | Hijau kebiruan |
| 5 | Biru | Hijau kebiruan |
| 6 | Biru cerah | Hijau kebiruan |
| 7 | Biru cerah | Hijau kebiruan |
| 8 | Biru kemerahan | Hijau kebiruan |
| 9 | Biru kemerahan | Hijau kebiruan |
| 10 | Kuning kehijauan | Hijau, ada endapan kuning |


PEMBAHASAN
Percobaan dilakukan dengan menguji enzim yang terkandung dalam air liur (saliva). Enzim berfungsi meningkatkan laju sehingga terbentuk kesetimbangan kimia antara produk dan pereaksi. Pada keadaaan kesetimbangan, istilah pereaksi dan produk tidaklah pasti dan bergantung pada pandangan kita. Dalam keadaan fisiologi yang normal, suatu enzim tidak mempengaruhi jumlah produk dan pereaksi yang sebenarnya dicapai tanpa kehadiran enzim. Jadi, jika keadaan kesetimbangan tidak menguntungkan bagi pembentukan senyawa, enzim tidak dapat mengubahnya (Salisbury dan Ross 1995).
Faktor-faktor yang dapat mempengaruhi fungsi enzim antara lain suhu , pH, konsentrasi substrat, konsentrasi enzim dan zat-zat penghambat. Suhu berpengaruh terhadap fungsi enzim karena reaksi kimia menggunakan katalis enzim yang dapat dipengaruhi oleh suhu. Di samping itu, karena enzim adalah suatu protein, maka kenaikan suhu dapat menyebabkan denaturasi dan bagian aktif enzim akan terganggu, sehingga konsentrasi dan kecepatan enzim berkurang. Kemudian pH berpengaruh terhadap fungsi enzim karena pada umumnya efektifitas maksimum suatu enzim pada pH optimum, yang lazimnya berkisar antara pH 4,5 – 8,0. Pada pH yang terlalu tinggi atau terlalu rendah umumnya enzim menjadi non aktif secara irreversibel karena menjadi denaturasi protein.
Kondisi pH dapat mempengaruhi aktivitas enzim melalui pengubahan struktur atau pengubahan muatan pada residu yang berfungsi dalam pengikatan substrat atau katalis. Sebagai contoh, enzim bermuatan negatif (Enz-) bereaksi dengan substrat bermuatan positif (SH+) : Enz- + SH+ EnzSH. Pada pH yang rendah, Enz- mengalami protonasi dan kehilangan muatan negatifnya (enzim dinetralisir) : Enz- + H+ EnzH. Sedangkan pada pH yang tinggi, SH+ mengalami ionisasi dan kehilangan muatan positifnya (substrat dinetralisir) : SH+ S + H+. Karena (berdasarkan definisi) satu-satunya bentuk yang mengadakan interaksi adalah SH+ dan Enz-, nilai pH yang ekstrim (tinggi ataupun rendah) akan menurunkan kecepatan reaksi (Peodjiadi 2006).
Enzim amilase saliva memiliki pH optimal pada pH 7, karena pada pH ini diperoleh aktivitas enzim yang tinggi (kecepatan reaksi enzimatik tinggi). Umumnya, kecepatan reaksi enzimatik meningkat hingga mencapai pH optimal dan menurun setelah pH lebih besar dari pH optimal. Hasil percobaan, pada pH 1 (uji Iod) dan pH 5 (uji benedict) aktivitas enzim masih ada, tetapi kecil (ditunjukkan oleh kecepatan reaksi enzimatik yang kecil pula). Hal ini disebabkan pada pH kurang dari 4, enzim amilase saliva menjadi tidak aktif. Menurut Amerongen (1991) amilase yang terdapat dalam saliva adalah α-amilase liur yang mampu membuat polisakarida (pati) dan glikogen dihidrolisis menjadi maltosa dan oligosakarida lain dengan menyerang ikatan glikosodat α(1 4). Amilase liur akan segera terinaktivasi pada pH 4,0 atau kurang sehingga kerja pencernaan makanan dalam mulut akan terhenti apabila lingkungan lambung yang asam menembus partikel makanan. Pada pH 1 diperoleh hasil positif pada uji iod dan hasil negatif pada uji benedict. Seharusnya hasil yang diperoleh uji iod dan uji benedict adalah negatif, sebab pada pH tersebut enzim amilase tidak aktif dan karbohidrat pun seharusnya terhidrolisis karena pemanasan dan pH yang sangat asam.
Uji iod terhadap campuran saliva dan pati yang memiliki pH 5 menunjukkan warna kuning pudar yang menunjukkan hasil yang negatif. Hal tersebut dikarenakan pH yang digunakan terlalu rendah untuk kerja optimum enzim amilase pada saliva yang digunakan. Sementara pada pH 7 dan 9, uji ini memberikan reaksi yang positif. Hasil uji Benedict menunjukkan reaksi negatif pada pH 1 dan menunjukkan reaksi positif pada pH 5, 7, dan 9. Hal ini menunjukkan bahwa enzim amilase tidak bekerja pada pH yang terlalu rendah maupun terlalu tinggi. Dari hasil uji Benedict ini warna kuning pekat dimiliki oleh tabung yang ber-pH 5. Oleh karena itu berdasarkan hasil percobaan pH optimum untuk aktivitas enzim amilase adalah pada pH 5. Padahal pada umumnya pH optimum saliva adalah mendekati 7. Hal ini dapat disebabkan oleh kesalahan-kesalahan pada saat praktikum seperti faktor pemanasan yang tidak berjalan stabil pada suhu 37oC karena terputusnya aliran listrik. Faktor pengocokan yang kurang sempurna juga dapat mempengaruhi hasil ini. Selain itu, larutan dengan variasi pH yang dibuat pun tidak cukup akurat untuk dijadikan indikasi pengukuran laju reaksi optimum enzinm dengan variabel pH, karena pembuatan larutan pun masih dalam skala kualitatif bukan kuantitatif.
Dalam saliva yang tidak dipanaskan, dihasilkan warna ungu yang makin lama makin jernih. Hal ini menunjukkan bahwa pada suhu optimum, enzim amilase dapat menjalankan fungsinya, mengubah amilum menjadi maltosa. Amilum dan dekstrin yang molekulnya masih besar dengan iodium memberi warna biru, dekstrin-dekstrin antaranya (eritrodekstrin) memberi warna coklat kemerah-merahan. Sedangkan dekstrin-dekstrin yang molekulnya sudah kecil lagi (akhrodekstrin) dan maltosa tidak memberi warna dengan iodium. Titik saat campuran tidak memberi warna lagi (jernih) disebut titik akromatik. Bila setelah uji iod tidak berwarna diadakan uji Benedict akan memberikan warna positif yang berwarna hijau. Pada uji benedict, teori yang mendarsarinya adalah gula yang mengandung gugus aldehida atau keton bebas akan mereduksi ion Cu2+ dalam suasana alkalis, menjadi Cu+, yang mengendap sebagai Cu2O (kupro oksida) berwarna merah bata. Berikut reaksi yang berlangsung:
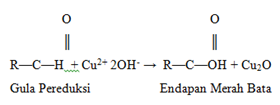 Gambar 7. Reaksi gula pereduksi
Gambar 7. Reaksi gula pereduksi
Uji iod terhadap hidrolisis pati oleh amilase air liur mencapai titik akromatik pada menit ke-22. Titik akromatik yaitu titik saat larutan uji dengan larutan iod menghasilkan reaksi negatif (pati sudah hilang). Sedangkan uji Benedict menunjukkan hasil yang positif.
Percobaan hidrolisis pati mentah menunjukkan reaksi negatif untuk uji Benedict karena pati mentah lebih sulit dihidrolisis oleh amilase. Sedangkan pada uji iod hidrolisis pati mentah juga menunjukkan hasil yang positif. Titik akhromatik hidrolisis pati mentah adalah pada menit ke-10. Jika dibandingkan titik akhromatik hidrolisisnya, pati mentah lebih lambat mencapai titik akhromatik dibandingkan pada hidrolisis pati matang.
KESIMPULAN
Enzim amilase dapat bekerja optimal pada pH optimumnya, yaitu sekitar pada pH 7 dan sekitarnya. Enzim akan berkurang laju reaksinya atau akan rusak pada pH yang ekstrim, yang di bawah pH 4,0 dan di atas pH 10. Berdasarkan data yang diperoleh titik akhromatik pati matang lebih lambat (menit ke-22) dari pati mentah menit (ke-10). Hal tersebut dikarenakan pada pati matang dilakukan pengukuran tiap 5 menit sekali sedangkan pada pati mentah tiap 1 menit sekali. Jadi pada dasarnya yang lebih cepat adalah titik akhromatik pati matang. Enzim amilase juga diketahui lebih cepat menghidrolisis pati matang daripada pati mentah.
DAFTAR PUSTAKA
Aisjah Girindra. 1986. Enzim dalam Biokimia 1. Jakarta: Gramedia.
Amerongen AVN. 1991. Ludah dan Kelenjar Ludah : Arti Bagi Kesehatan Gigi. Surabaya : Gadjah Mada University Press.
Hart H et al. 2003. Kimia Organik Suatu Kuliah Singkat. Jakarta : Erlangga
Kidd BSJ. 1992. Dasar-dasar karies penyakit dan penanggulangannya. Jakarta: EGC.
Poedjiadi A. 2006. Dasar-dasar Biokimia. Jakarta: UI Press
Suharso M. 1986. Enzim dalam Biokimia. Yogyakarta: Gadjah Mada University Press.
Wirahadikusumah M. 1989. Biokimia: Protein, Enzim, dan Asam Nukleat. Bandung : Penerbit ITB.
Tags: Biology | 1 comments
Penentuan Kadar Glukosa Dalam Darah
| Ayun
| Laporan Praktikum Biokimia Umum | Hari/tanggal : Selasa/21 Desember 2010 Waktu : 08.00 – 11.00 WIB PJP : Waras Nurcholis, M. Si Asisten : Resti Siti Mutmainah
|
PENENTUAN KADAR GLUKOSA DALAM DARAH
KELOMPOK 10
Randi Hadianta (G34090020)
Yovita Sari (G34090028)
Kurrataa’yun (G34090105)
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
2010
PENDAHULUAN
Glukosa, suatu gula monosakarida adalah salah satu karbohidrat terpenting yang digunakan sebagai sumber tenaga bagi hewan dan tumbuhan. Glukosa merupakan salah satu hasil utama fotosintesis dan awal bagi respirasi. Bentuk alami (D-glukosa) disebut juga dekstrosa, terutama pada industri pangan. Glukosa adalah suatu aldoheksosa dan sering disebut dekstrosa karena mempunyai sifat dapat memutar cahaya terpolarisasi ke arah kanan. Di alam, glukosa terdapat dalam buah-buahan dan madu lebah (Poedjiadi 1994).
Bila kadar gula dalam darah melebihi atau kurang dari batas normal maka sistem metabolisme dalam tubuh akan terganggu. Darah manusia normal mengandung glukosa dalam jumlah atau konsentrasi tetap, yaitu antara 70-100 mg tiap 100 ml darah. Glukosa darah ini dapat bertambah setelah kita makan makanan sumber karbohidrat, namun kira-kira 2 jam setelah itu, jumlah glukosa darah akan kembali pada keadaan semula. Salah satu contoh penyakit yang disebabkan oleh kelainan kadar glukosa yaitu diabetes mellitus. Diabetes mellitus atau yang lebih dikenal dengan kencing manis merupakan penyakit yang timbul karena suatu gangguan dari pankreas, yaitu organ tubuh yang biasa menghasilkan insulin dan sangat berperan dalam metabolisme glukosa bagi sel tubuh. Seseorang yang terkena diabetes mellitus selalu ditandai oleh naiknya kadar gula darah (hiperglikemia) dan tingginya kadar gula dalam urine (Achjadi 2003). Pada orang yang menderita diabetes mellitus atau kencing manis, jumlah glukosa darah lebih besar dari 130 mg per 100 ml darah (Poedjiadi, 1994).
Pada hewan terdapat salah satu penyakit yang dinamakan Hypocalcaemia. Hypocalcaemia adalah penyakit metabolisme pada hewan yang terjadi pada waktu atau segera setelah melahirkan yang manifestasinya ditandai dengan penderita yang mengalami depresi umum (Subronto 2001). Hypocalcaemia dapat menghambat ekskresi insulin sehingga pada kasus ini biasanya selalu diikuti kenaikan kadar glukosa. (Girindra 1988).
Glukosa darah dapat ditentukan dengan berbagai cara baik secara kimiawi maupun secara enzimatik. Prisip penentuannya didasari pada kemampuan glukosa untuk mereduksi ion anorganik seperti Cu2+ atau Fe(CN)63-. Penentuan glukosa secara reaksi reduksi kurang spesifik dibanding cara enzimatik, terutama bila dalam darah terdapat bahan yang dapat mereduksi misalnya kreatinin, asam urat dan gula-gula lain selain glukosa (manosa, galaktosa dan laktosa) yang akan memberikan hasil pemeriksaan yang lebih tinggi daripada kadar glukosa yang sebenarnya. Sebagai pedoman dapat diperkirakan bahwa hasil penentuan glukosa secara reduksi akan memberikan hasil 3,6 -10,8 mg % lebih tinggi daripada cara enzimatik. Perbedaan ini akan lebih besar lagi bila terdapat peningkatan kreatinin dan asam urat (Suryohudoyo & Purnomo 1996).
TUJUAN
Praktikum ini bertujuan untuk menentukan kadar gula pereduksi (glukosa) dalam darah dengan metode spektrofotometri.
ALAT DAN BAHAN
Alat-alat yang digunakan dalam praktikum ini adalah tabung reaksi, tabung erlenmeyer, pipet tetes, pipet volumetrik 10 mL, pipet volumetric 1 mL, penangas air, kertas saring, gegep, spekronik-20, dan tabung Folin Wu..
Bahan praktikum yang digunakan adalah darah, H2SO4 0,67 N, akuades, Na-Wolframat 10%, kupritartrat, larutan standar glukosa, dan larutan fosfolibdat.
PROSEDUR PERCOBAAN
Penentuan kadar glukosa dalam darah dilakukan dengan beberapa tahapan. Tahap awal dengan membuat filtrat penyaringan darah yang akan digunakan dalam pengukuran kadar. Pembuatan filtrat dilakukan dengan mencampurkan 1 mL darah, 7 mL akuades, dan 1 mL Na-Wolframat 10% di dalam tabung erlenmeyer kecil. Campuran tersebut pun dikocok dan ditetesi dengan 1 mL H2SO4 0,67 N secara perlahan. Selanjutnya hasil campuran tersebut didiamkan tanpa dikocok selama 10 menit yang kemudian disaring untuk mendapatkan filtratnya.
Pengujian dilakukan dengan beberapa perlakuan, yaitu perlakuan blanko, standar glukosa, dan tiga pengujian terhadap filtrat. Perlakuan blanko dimasukkan 1 mL akuades dengan 1 mL kupritartrat. Perlakuan standar glukosa didapatkan dengan mencampurkan 1 mL larutan standar glukosa dengan 1 mL kupritartrat. Sementara untuk filtrat didapatkan dengan mencampurkan 1 mL filtrat dengan 1 mL kupritartrat. Ketiga perlakuan tersebut dilakukan secara bersamaan (pada waktu yang sama). Ketiga jenis perlakuan tersebut dipanaskan dalam air mendidih selama 8 menit tepat. Perlakuan yang telah dipanaskan pun didinginkan dan diencerkan dengan menambahkan 7 mL akuades pada setiap perlakuan. Selanjutnya pada setiap tabung dimasukan mL fosfomolibdat pada waktu yang bersamaan untuk setiap perlakuan. Pengukuran pun dilakukan dengan menggunakan spektronik-20. Penggunaan spektronik-20 dilakukan dengan men-tera alat terlebih dahulu. Tera dilakukan dengan memasukkan larutan blanko ke dalam tabung pupet dan dimasukkan ke dalam spektronik, selanjutnya ditekan tombol ‘blank’. Kemudian dilakukan hal yang sama pada setiap perlakuan tanpa menekan tombol blank. Angka yang tertera pada spektronik-20 menunjukkan tingkat absorban larutan. Tingkat absorban larutan pun dicatat yang kemudian akan dihitung untuk menentukan kadar glukosa di dalam darah.
HASIL PENGAMATAN
Tabel 1. Penentuan kadar glukosa darah
| Larutan | Absorban | [glukosa darah] (mg/dL) | [glukosa darah]rata-rata (mg/dL) |
| Blanko | 0,000 | 0,000 | 53,732 |
| Standar glukosa | 0,451 | 10,000 | |
| Filtrat 1 | 0,276 | 61,197 | |
| Filtrat 2 | 0,260 | 57,650 | |
| Filtrat 3 | 0,191 | 42,350 |
Contoh perhitungan:
CStandar glukosa = 0,1 mg/mL = 10 mg/dL
Kadar glukosa darah (mg/dL) =

= 61,197 mg/dL
Kadar glukosa darah filtrat 2 (mg/dL) =
= 57,650 mg/dL
Kadar glukosa darah filtrat 3 (mg/dL) =
= 42,350 mg/dL
Kadar glukosa darah filtrat rata-rata (mg/dL) =
= 53,732 mg/dL

PEMBAHASAN
Uji glukosa darah pada praktikum ini menggunakan metode spektofotometri. Menurut (Syabatini 2010), spektrofotometri merupakan suatu metoda analisa yang didasarkan pada pengukuran serapan sinar monokromatis oleh suatu lajur larutan berwarna pada panjang gelombamg spesifik dengan menggunakan monokromator prisma atau kisi difraksi dengan detektor fototube. Spektrofotometer adalah alat untuk mengukur transmitan atau absorban suatu sampel sebagai fungsi panjang gelombang. Sedangkan pengukuran menggunakan spektrofotometer ini, metoda yang digunakan sering disebut dengan spektrofotometri. Spektrofotometri dapat dianggap sebagai perluasan suatu pemeriksaan visual dengan studi yang lebih mendalam dari absorbsi energi. Absorbsi radiasi oleh suatu sampel diukur pada berbagai panjang gelombangdan dialirkan oleh suatu perkam untuk menghasilkan spektrum tertentu yang khas untuk komponen yang berbeda.
Pembuatan filtrat dilakukan dengan memipet 1 ml darah ke dalam erlenmeyer kecil, serta ditambahkan 1 mL Na-wolframat 10%, dan 1 mL H2SO4 0,67 N tetes demi tetes. Fungsi penambahan akuades adalah mengencerkan darah sehingga albumin dalam darah akan larut oleh akuades. Menurut Poedjiadi (1994), albumin adalah protein yang dapat larut dalam air serta dapat terkoagulasi oleh panas. Albumin terdapat dalam serum darah dan putih telur. Penambahan Na-wolframat bertujuan mengendapkan albumin yang terlarut dalam air. H2SO4 berfungsi sebagai katalisator untuk mempercepat reaksi pengendapan albumin oleh Na-wolframat.
Larutan yang telah dibuat didiamkan selama 10 menit agar terjadi endapan albumin secara sempurna, sehingga ketika endapan tersebut dipisahkan dengan kertas saring akan memisah dengan sempurna. Selanjutnya tabung reaksi yang telah berisi masing-masing bahan, berturut-turut filtrat, standar glukosa, dan akuades ditambahkan 1 mL larutan kupritartrat. Penambahan larutan kupritartrat berfungsi dalam pembentukan warna biru ketika ditambahkan pereaksi fosfomolibdat. Hal tersebut dapat terjadi karena larutan kupritartrat mengandung asam laktat dan ion Cu+. Menurut Girinda (1989), pada penambahan kupritartrat, ion kupri akan direduksi oleh gula menjadi kupro dan mengendap sebagai Cu2O. Penambahan pereaksi fosfomolibdat kuprooksida melarut lagi dan warna larutan akan berubah menjadi biru tua disebabkan oleh adanya oksidasi Mo. Intensitaas warna larutan adalah ukuran banyaknya gula yang ada di dalam filtrat. Hasil percobaan ini sesuai dengan prinsip uji tauber yang memberikan hasil positif (warna biru) pada larutan yang mengandung monosakarida (glukosa).
Selanjutnya ketiga tabung tersebut dipanaskan dengan air mendidih selama 8 menit tepat. Pemanasan berfungsi menambah laju reaksi oleh kupritartat. Ketiga tabung tersebut didinginkan, lalu diencerkan dengan 7 ml akuades. Sebanyak 1 mL larutan fosfomolibdat ditambahkan pada setiap tabung. Penambahan H2SO4 0,67 N bertujuan untuk menciptakan suasana asam, karena reaksi dengan fosfomolibdat terjadi pada suasana asam. Perubahan warna yang terjadi diamati dan intensitas warnanya diamati dengan spektronik-20 pada panjang gelombang 660 nm.
Pengamatan dengan spektronik-20 menggunakan prinsip hukum Lambert Beer. Suatu spektrofotometer tersusun dari sumber spektrum sinar tampak yang sinambung dan monokromatis. Sel pengabsorbsi untuk mengukur perbedaan absorbsi antara cuplikan dengan blanko ataupun pembanding. Adapun penggunaan panjang gelombang sebesar 660 nm disebabkan karena panjang gelombang maksimum untuk transmitansi larutan glukosa adalah 660nm (Syabatini 2010).
Hasil pengukuran kadar glukosa dalam darah yang telah dilakukan pada praktikum ini menunjukkan bahwa larutan standar glukosa memiliki kadar glukosa 10 mg/dL (sesuai dengan literatur). Larutan blanko yang merupakan campuran dari kupritartrat dan akuades memiliki kadar glukosa 0,000 mg/dL. Sementara kandungan glukosa dalam darah setelah dirata-ratakan dari ketiga pengulangan adalah 53,372 mg/dL. Sehingga dapat diketahui bahwa yang digunakan dalam praktikum adalah darah ayam.
Kadarglukosa darah normal 50 –100 /dL ( 50/18 –100/18 mmol/dL ). Hepar mempertahankan glukosa dengan glikogenolisis dan glukoneogenesis, dibawah kontrol hormonal (glukagon atau kalau turunnya drastis menjadi epinefrin). Apabila glukosa darah turun, glukagon dilepas pankreas,glukagon akan mengaktifkan adenilil siklase, enzim ini akan mengkatalisis pembentukan cAMP dari ATP, cAMP akan mengaktifkan cAMP dependent protein kinase, yang selanjutnya akan mengubah fosforilase kinase b a (dengan fosforilasi membutuhkan ATP). Fosforilase kinase a akan mengaktifkan fosforilase (fosforilase fosforilase-P). Selanjutnya fosforilase yang aktif memecah glikogen menghasilkan G 1P. Bersama dgn enzim glukantransferase dan debrancing enzim glikogen akan dipecah semuanya.
Bila kadar gula dalam darah melebihi atau kurang dari batas normal maka sistem metabolisme dalam tubuh akan terganggu. Salah satu contoh penyakit yang disebabkan oleh kelainan kadar glukosa yaitu diabetes melitus. Terdapat dua jenis penyakit diabetes melitus yaitu diabetes melitus tipe 1 (insulin-dependent diabetes mellitus) yaitu kondisi defisiensi produksi insulin oleh pankreas. Kondisi ini hanya bisa diobati dengan pemberian insulin. Diabetes melitus tipe 2 (non-insulin-dependent diabetes mellitus) yang terjadi akibat ketidakmampuan tubuh untuk berespons dengan wajar terhadap aktivitas insulin yang dihasilkan pankreas (resistensi insulin), sehingga tidak tercapai kadar glukosa yang normal dalam darah. Diabetes melitus tipe 2 ini lebih banyak ditemukan dan diperkirakan meliputi 90% dari semua kasus diabetes di seluruh dunia (Suryohudoyo 1996).
Selain diabetes, penyakit yang diakibatkan ketidakseimbangan glukosa adalah polyuria. Menurut Dorland (2002), Polyuria adalah kondisi dimana ekskresi urin yang besar atau berlebihan dalam periode tertentu. Sedangkan diabetes adalah adanya berbagai gangguan yang ditandai dengan polyuria. Polifagia terjadi akibat jaringan tubuh tidak mendapatkan suplai glukosa yang cukup akibat gagalnya insulin membuka kanal glukosa. Akibatnya, glukosa darah menumpuk, namun tubuh tetap merasa lapar. Karena glukosa tidak dapat mencukupi kebutuhan energi jaringan, maka tubuh mengambil energi tersebut dari sumber energi yang lain, seperti lemak atau protein, sehingga lama kelamaan pasien menjadi semakin kurus. Selanjutnya, karena ginjal mempunyai ambang batas tertentu terhadap filtrasi glukosa, maka glukosa ikut lolos sehingga keluar bersama urin. Karena itu pengujian urin untuk glukosa reduksi mempunyai hasil posisitif (+++). Untuk menjaga agar urin tidak terlalu pekat, ginjal mempunyai sistem pengaturan sendiri, sehingga cairan tubuh ikut keluar bersama urin, dan jaringan tubuh mengalami dehidrasi. Sebab itu, penderita DM pada umumnya merasa sering haus (polidipsi). Gejala klinis berupa polineuropati dan retinopati berkaitan dengan akumulasi fruktosa dan sorbitol. Secara umum, penumpukan fruktosa dan sorbitol mengganggu kerja sistem saraf, namun secara khusus keduanya jelas terlibat dalam patogenesis katarak diabetika. Kadar kreatinin dan hasil uji protein urin yang abnormal juga menunjukkan salah satu komplikasi DM, yaitu defisiensi kerja ginjal. Ginjal tidak mampu menyaring protein dengan baik, sehingga protein ikut terlarut dalam urin. Adanya kalsifikasi pada pankreas menunjukkan terganggunya fungsi pankreas dalam memproduksi insulin dalam jumlah normal.
KESIMPULAN
Kadar gula pereduksi dalam darah dapat dilakukan dengan uji spektofotometri. Hasil uji kadar gula dalam darah sampel yaitu 53,732mg/dL. Pengetahuan tentang kadar gula dalam darah sangat penting untuk metabolisme tubuh.
DAFTAR PUSTAKA
Achjadi K. 2003. Penyakit Gangguan Metabolisme. Bogor : IPB Press.
Dorland W.A Newman. 2002. Kamus Kedokteran Dorland Edisi 29. Jakarta: EGC.
Girindra A.1988. Biokimia I. Jakarta : Gramedia
_________.1989. Biokimia Patologi. Bogor: IPB Press.
Poedjiadi Anna 1994. Dasar-dasar Biokimia. Jakarta: UI Press.
Subronto. 2001. Ilmu Penyakit Ternak II. Yogyakarta : Gadjah Mada University Press.
Suryohudoyo P & Purnomo SU. 1996. Dasar Molekuler Diabetes Mellitus (DM), Naskah Lengkap Surabaya Diabetes Update-I : 71-73.
Syabatini Annisa. 2010. Analisis Campuran Dua Komponen Tanpa Pemisahan Dengan Spektrofotometer. Pontianak : UNLAM Press.
Tags: Biology | 1 comments
Karbohidrat
Senin, 23 Januari 2012 | Ayun
| Laporan Praktikum Biokimia Umum | Hari/tanggal : Selasa/05 Oktober 2010 Waktu : 08.00 – 11.00 WIB PJP : Waras Nurcholis Asisten : 1. Syaefuddin 2. Osy Yostia 3. Utami Andri |
KARBOHIDRAT
KELOMPOK 10
Randi Hadianta (G34090020)
Yovita Sari (G34090028)
Kurrataa’yun (G34090105)
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
2010
_____________________________________________________________________
PENDAHULUAN
Karbohidrat adalah kelompok nutrien yang penting dalam susunan makanan sebagai sumber energi. Senyawa – senyawa ini mengandung unsur karbon, hydrogen, oksigen dan dihasilkan oleh tanaman dengan proses fotosintesa (Gaman & Sherrington 1992)
Karbohidrat terdiri atas sakar-sakar dan tepung. Nutrien ini dibagi dalam tiga golongan besar dan nama dari golongan-golongan ini diambil dari rumus umum kimiawinya yaitu monosakarida (C6H12O6), Disakarida (C12H22O11), Polisakarida (C6H10O5)x (Nicholls 1971).
Monosakarida merupakan jenis karbohidrat sederhana yang terdiri dari satu gugus cincin. Contoh dari monosakarida yang banyak terdapat di dalam sel tubuh manusia adalah glukosa, fruktosa dan galaktosa. Selain sebagai molekul tunggal, monosakarida juga akan berfungsi sebagai molekul dasar bagi pembentukan senyawa karbohidrat kompleks pati (starch) atau selulosa.
Disakarida merupakan jenis karbohidrat yang banyak dikonsumsi oleh manusia di dalam kehidupan sehari-hari. Setiap molekul disakarida akan terbentuk dari gabungan 2 molekul monosakarida. Contoh disakarida yang umum digunakan dalam konsumsi sehari-hari adalah sukrosa yang terbentuk dari gabungan 1 molekul glukosa dan fruktosa; laktosa yang terbentuk dari gabungan 1 molekul glukosa & galaktosa. Selain itu, contoh disakarida adalah sakarosa dan maltosa. Di dalam produk pangan, sukrosa merupakan pembentuk hampir 99% dari gula pasir atau gula meja yang biasa digunakan dalam konsumsi sehari-hari sedangkan laktosa merupakan karbohidrat yang banyak terdapat di dalam susu sapi dengan konsentrasi 6.8 gr / 100 ml (Irawan 2007).
Karbohidrat kompleks merupakan karbohidrat yang terbentuk oleh hampir lebih dari 20.000 unit molekul monosakarisa terutama glukosa, yang disebut polisakarida. Di dalam ilmu gizi, jenis karbohidrat kompleks yang merupakan sumber utama bahan makanan yang umum dikonsumsi oleh manusia adalah pati (starch). Pati umumnya akan terbentuk dari dua polimer molekul glukosa yaitu amilosa (amylose) dan amilopektin (amylopectin). Amilosa merupakan polimer glukosa rantai panjang yang tidak bercabang sedangkan amilopektin merupakan polimer glukosa dengan susunan yang bercabang-cabang. Komposisi kandungan amilosa dan amilopektin ini akan bervariasi dalam produk pangan dimana produk pangan yang memiliki kandungan amilopektin tinggi akan semakin mudah untuk dicerna. Contoh polisakarida lainnya adalah Glikogen (Irawan 2007).
TUJUAN
Praktikum kali ini bertujuan untuk mengetahui dan membuktikan kandungan karbohidrat yang ada pada berbagai macam zat gula seperti glukosa, fruktosa, sukrosa, laktosa, maltosa, dan pati. Selain itu praktikum ini juga bertujuan untuk membedakan jenis-jenis gula yang terdiri atas golongan monosakarida dan disakarida.
METODE PRAKTIKUM
Praktikum Biofisik 2 ini dilakukan di Lab. Bio 1 pada hari Selasa, 05 Oktober 2010, pukul 08.00 – 11.00 WIB.
Praktikum kali ini terdiri dari tujuh pengujian Karbohidrat. Pengujian pertama ialah uji Molisch. Masukkan 5 ml larutan yang akan diujikan ke tabung reaksi lalu dimasukkan 2 tetes pereaksi Molisch, diaduk lalu ditambahkan 3 ml Asam Sulfat pekat. Pengujian dilakukan untuk larutan glukosa 1%, fruktosa 1%, sukrosa 1%, laktosa 1%, maltose 1%, pati 2%.
Pengujian kedua ialah uji Benedict. Sebanyak 5 ml benedict dimasukkan ke tabung reaksi dan 8 tetes larutan yang akan diuji, dicampur dan dididihkan selama 5 menit lalu didinginkan. Perubahan warnanya diamati. Pengujian ke tiga ialah uji Barfoed. Sebanyak 1 ml pereaksi dan 1 ml larutan yang akan diuji dimasukkan ke dalam tabung reaksi lalu dipanaskan ke dalam air mendidih selama 3 menit dan didinginkan. Lalu sebanyak 1 ml fosfomolibdat dimasukkan, dikocok dan diamati perubahan warnanya.
Pengujian keempat ialah uji fermentasi. Sebanyak 20 ml larutan bahan yang akan diuji dengan 2 gram ragi roti dimasukkan ke dalam mortar. Kedua campuran tersebut digerus hingga homogen. Lalu larutan tadi dimasukkan ke dalam tabung fermentasi. Tabung tersebut lalu dierami pada suhu 360 dan diperiksa selang 30 menit selama 3 kali pengamatan. Kemudian diamati apakah ada ruangan gas pada kaki tabung, perubahan tersebut dicatat. Untuk pembuktian, dimasukkan 10% NaOH kedalam tabung reaksi melalui mulut terbuka dan ditutup mulut tabung dengan jempol, dibolak balik beberapa kali, dirasakan ada atau tidak isapan yang terjadi.
Uji yang kelima ialah uji Selliwanoff. Sebanyak 5 ml pereaksi Selliwanoff dan beberapa tetes bahan percobaan dicampur. Campuran tersebut dididihkan selama 1-5 menit. Diamati perubahan warna yang terjadi.
Uji yang keenam ialah uji Osazon.Ccampuran fenil hidrazin Na asetat kering dimasukkan ke dalam tabung reaksi kira-kira memenuhi bagian bundar tabung. Sebanyak 5 ml larutan percobaan ditambahkan, kemudian dilakukan pengocokan dan selanjutnya tabung reaksi dipanaskan di penangas air selama 30 menit. Didinginkan dan diamati dibawah mikroskop.
Uji Iod ialah pengujian terakhir. Pada papan uji dimasukkan sedikit tepung bahan percobaan kemudian diteteskan setetes iod encer. Kedua campuran tadi diaduk dan diamati perubahan warna yang terjadi.
HASIL DAN PEMBAHASAN
Tabel 1. Pengamatan Uji Molisch
| Larutan | Hasil Uji | Pengamatan |
| Glukosa 1% Fruktosa 1% Sukrosa 1% Laktosa 1% Maltosa 1% Pati 1% | + + + + + + | Ungu muda bening Ungu pekat Ungu pekat Ungu muda Ungu muda Ungu muda |
Ket : + = reaksi positif (menunjukkan kepekatan warna cincin)
- = reaksi negatif
Gambar 1. Hasil uji molisch Glukosa, Fruktosa, Sukrosa, Laktosa, Maltosa, dan Pati (dari kiri ke kanan)
Tabel 2 Pengamatan Uji Benedict
| Larutan | Hasil Uji | Keterangan |
| Glukosa 1% Fruktosa 1% Sukrosa 1% Laktosa 1% Maltosa 1% Pati 1% | + + - + + + | Merah bata cerah Merah bata pekat Tidak ada endapan Merah bata Jingga bata Merah bata cerah |
Ket : + = reaksi positif (menunjukkan banyaknya endapan)
- = reaksi negatif
Gambar 2. Hasil Uji Benedict Glukosa, Fruktosa, Sukrosa, Laktosa, Maltosa, dan Pati (dari kiri ke kanan)
Tabel 3. Pengamatan Uji Barfoed
| Larutan | Hasil Uji | Keterangan |
| Glukosa 1% Fruktosa 1% Sukrosa 1% Laktosa 1% Maltosa 1% Pati 1% | +++ +++ ++ ++ + - | Biru bening Hijau bening Biru bening Biru bening Biru bening Biru bening |
Ket : + = reaksi positif (menunjukkan kepekatan warna)
- = reaksi negatif
Gambar 3. Hasil uji Barfoed Glukosa, Fruktosa, Sukrosa, Laktosa, Maltosa, dan Pati (dari kiri ke kanan)
Tabel 4. Pengamatan Uji Fermentasi
Gambar 4. Gambar hasil uji fermentasi
Tabel 5. Pengamatan Uji Seliwanof
| Larutan | Hasil Uji | Keterangan |
| Glukosa 1% Fruktosa 1% Sukrosa 1% Laktosa 1% Maltosa 1% Pati 2% | - + + - - - | Kuning bening (tetap) Merah Merah Kuning bening Kuning bening Kuning bening |
Ket : + = ada endapan
- = tidak ada endapan

Tabel 6. Hasil Uji Osazon
| Larutan | Pengamatan mikroskop | Literatur |
| Glukosa 1%
Fruktosa 1%
Sukrosa 1%
Laktosa 1%
Maltosa 1%
Pati 2% | 10 x 10 10 x 10 10 x 10 10 x 10 10 x 10 10 x 10 | Sumber: http://www.didier-pol.net/3osazon.htm
|
Tabel 7 Pengamatan Uji Iod
| Larutan | Hasil Pengamatan |
| Gum Arab | Gambar 6. |
| Pati | Gambar 7. |
| Agar-agar | Gambar 8. |
Praktikum pertama dilakukan uji pereaksi Molisch. Uji molisch dilakukan untuk membuktikan adanya zat karbohidrat secara umum pada suatu zat atau gula. kondensasi dari hidroksi metal furfural (heksosa) atau furfural (pentosa) dengan alfa-naftol membentuk suatu cincin berwarna ungu. Pengamatan dilakukan terhadap 6 sampel zat, yaitu glukosa 1%, fruktosa 1%, sukrosa 1%, laktosa 1%, maltosa 1%, dan pati 2%. Berdasarkan hasil uji molisch (tabel 1.), semua zat tersebut bereaksi positif yang artinya semua zat tersebut mengandung karbohidrat. Ini dapat dilihat dari terbentuknya lapisan cincin tipis yang timbul dan berubahnya warna campuran menjadi keunguan, umgu muda dan ungu pekat.
Uji Benedict menunjukkan tentang adanya gula pereduksi pada sampel. Pada uji Benedict, pereaksi ini akan bereaksi dengan gugus aldehid, kecuali aldehid dalam gugus aromatik, dan alpha hidroksi keton. Enol yang reaktif mereduksi Cu2+ dari senyawa kompleks dengan sitrat menjadi Cu+. Cu+ bersama OH membentuk CuOH (berwarna kuning), yang dengan pemanasan akan berubah menjadi endapan Cu2O yang berwarna merah. Warna yang terbentuk bervariasi mulai dari hijau, kuning, orange, merah sampai endapan merah bata, tergantung jumlah Cu2O yang terbentuk, sehingga reaksi ini dapat digunakan untuk menentukan adanya gula baik secara kualitatif maupun kuantitatif (anonim, 2009). Reaksi positif menunjukkan bahwa zat tersebut merupakan zat pereduksi. Setelah dilakukan percobaan (tabel 2) yang termasuk gula pereduksi adalah glukosa, fruktosa, laktosa, maltosa, dan pati yang ditunjukkan dengan adanya endapan merah bata. Sedangkan sukrosa tidak termasuk gula pereduksi karena dari uji benedict tidak menghasilkan endapan merah bata. Menurut Riyadi (2010), sukrosa tidak bersifat pereduksi karena sukrosa mengandung dua monosakrida (fruktosa dan glukosa) yang terikat melalui ikatan glikosidik sedemikian rupa sehingga tidak mengandung gugus aldehid bebas dan alpha hidroksi keton.
Untuk membedakan antara monosakarida dan disakarida, dilakukan uji barfoed. Karbohidrat di dalam larutan asam lemah akan mengalami perubahan reaktifitas dan warna campuran akan menjadi warna biru. Senyawa berwarna biru tersebut akan terjadi dengan adanya fosfomolibdat. Berdasarkan pengamatan, yang termasuk reaksi positif (monosakarida) adalah glukosa 1% dan fruktosa 1% (tabel 3). Sedangkan yang termasuk reaksi negatif (disakarida) adalah sukrosa 1%, maltosa 1%, dan laktosa 1%. Khusus pati 1%, reaksi negatif menandakan golongan polisakarida. Pada reaksi negatif, tidak terjadi endapan pada dasar tabung.
Proses fermentasi adalah proses penguraian senyawa gula yang kompleks menjadi gula-gula sederhana. Seperti yang telah kita ketahui fruktosa merupakan senyawa monosakarida, yang akan lebih cepat mengalami fermentasi dibandingkan disakarida dan polisakarida. Ini dikarenakan monosakarida merupakan monomer karbohidrat yang paling sederhana. Selain itu jumlah atom C pada monosakarida lebih sedikit dibandingkan dengan disakarida dan polisakarida. Ini dapat dibuktikan pada percobaan uji fermentasi ini. Reaksi fermentasi yang terjadi pada fruktosa terjadi lebih cepat dan menghasilkan hasil samping berupa gas CO2 paling banyak. Sedangkan proses fermentasi pada paling lama karena pati merupakan senyawa kompleks yang memiliki banyak atom C (Polisakarida). Selain itu pada pati tidak ditemukan hasil samping berupa gas CO2 seperti pada zat lainnya (tabel 4). Pada uji ini dilakukan pengeraman pada suhu 36’C dan diperiksa setiap selang 30 menit sebanyak 3 kali pengamatan.
Reaksi selliwanof adalah suatu reaksi untuk mengidentifikasi adanya gugus keton pada suatu sakarida. Reagen selliwanof terdiri atas 0,5% resorsinol dan 5 N HCl . Reaksi positif apabila terbentuk warna merah. HCl akan mengubah heksosa menjadi hidroksi metal furfural yang kemudian akan bereaksi dengan resorsinol membentuk kompleks yang berwarna merah. Kereaktifan aldosa dan ketosa sangatlah berbeda. Aldosa untuk terhidrolisis membutuhkan asam pekat sedangkan ketosa membutuhkan asam encer sehingga hidroksi metal furfural dari aldosa sedikit. Sedangkan untuk ketosa hidroksi metal furfural yang terbentuk banyak. Karena itulah reaksi ini spesifik untuk fruktosa yang termasuk ketoheksosa. Pada sukrosa, HCl akan menghidrolisis sukrosa menjadi glukosa dan fruktosa. Akan tetapi karena kereaktifan antara glukosa dan fruktosa. Akan tetapi karena kereaktifan antara glukosa dan fruktisa terhadap HCL encer berbeda maka fruktosa akan lebih dahulu membentuk suatu senyawa hidroksimetil furfural yang kemudian akan bereaksi dengan resorsinol membentuk kompleks berwarna merah Sedangkan maltosa bila dihidrolisis akan menghasilkan 2 molekul glukosa yang kurang reaktif terhadap terhadapHCl encer, sehingga memberi efek yang negative terhadap resorsinol. (anonim, 2009). Hal tersebut sesuai dengan hasil uji selliwanoff, di mana hanya sukrosa dan fruktosa yang berreaksi positif (tabel 5)
Uji Iod pada praktikum ini bertujuan untuk mengetahui adanya kandungan amilum yang merupakan salah satu bentuk dari polisakarida. Amilum termasuk polisakarida. Polisakarida memiliki struktur yang spiral (menutup) yang pabila polisakarida ini (amilum) ditetesi Iod, maka molekul Iod akan terperangkap di dalamnya. Akibatnya larutan ini akan berwarna biru.
Ketika dipanaskan, amilum akan terhidrolisis menjadi monosakarida sehingga Iod bias terlepas. Selanjutnya ditambahkan NaOH maka I- akan bereaksi dengan Na+ membentuk NaI, akibatnya larutan akan menjadi bening. Hal ini tidak berlaku untuk jenis-jenis sakarida yang lain seperti monosakarida, disakarida, dan oligosakarida karena struktur mereka masih sederhana. Apabila dipanaskan maka ikatan antara Na dan I kembali renggang sehingga apabila didiamkan bias balik lagi dan terbentuk warna biru kembali.Pada percobaan ini, yang menghasilkan warna biru violet adalah tepung pati. Sedangkan uji Iod pada larutan Gum Arab, terlihat hasil berwarna kuning, cukup pekat, dan larut. Sehingga, dapat disimpulkan, hanya pati yang mengandung amilum.
Fenilhidrazin bereaksi dengan monosakarida dan beberapa disakarida membentuk hidrazon dan osazon. Hidrazon merupakan substansi yang mudah larut (soluble) dan sulit diisolasi. Sedang osazon kebalikannya, ia relatif tidak melarut dan membentuk kristal yang bentuknya spesifik untuk setiap jenis sakarida. Itulah sebabnya mengapa osazon menjadi begitu penting dalam membantu mengidentifikasi konfigurasi struktural dari sakarida. Reaksi pembentukan osazon adalah sebagai berikut:
Aldosa + fenilhidrazin ——→ fenilhidrazon
Fenilhidrazon + 2 fenilhidrazin ——→ Osazon + aniline + NH3 +H2O
Sukrosa tidak membentuk osazon, sementara glukosa, fruktosa, laktosa, dan maltose membentuk osazon.
KESIMPULAN
Glukosa, fruktosa, dan pati termasuk monosakarida, sedangkan sukrosa, laktosa, dan maltosa adalah disakarida. Dari semua jenis karbohidrat tersebut, hanya sukrosa yang bukan gula pereduksi.
DAFTAR PUSTAKA
Anonim. 2009. Karbohidrat [terhubung berkala] http://xa.yimg.com/kq /groups/ 26573843 /1083916692 /name /Karbohidrat.doc [05 Oktober 2010].
Irawan M. Anwari. 2007. Karbohidrat. Polton Sports Science and Performance Lab. Vol 01: 03.
Gaman P.M, K.B Sherrington. 1992. Ilmu Pangan. Yogyakarta: Gadjah Mada University Press.
Nicholls L.1976. Ilmu Gizi dan Ilmu DIIT di Daerah Tropik. Jakarta: Balai Pustaka.
Riyadi W. 2009. Uji Benedict, Uji Gula Pereduksi [terhubung berkala] http://wahyuriyadi.blogspot.com/2009/10/uji-benedict-adalah-uji-kimia-untuk.html [05 Oktober 2010].
Tags: Biology | 1 comments
Lipid
| Ayun
| Laporan Praktikum Biokimia Umum | Hari/tanggal : Selasa/09 November 2010 Waktu : 08.00 – 11.00 WIB PJP : Waras Nurcholis Asisten : 1. Osy Yostia 2. Syaefuddin 3. Resti Siti Mutmainah |
LIPID
KELOMPOK 10
Randi Hadianta (G34090020)
Yovita Sari (G34090028)
Kurrataa’yun (G34090105)
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
2010
__________________________________________________________________________________
PENDAHULUAN
Lipid adalah senyawa organik berminyak atau berlemak yang tidak larut dalam air, dapat diekstrak dari sel dan jaringan oleh pelarut nonpolar, seperti kloroform dan eter. Asam lemak adalah komponen unit pembangun pada hampir semua lipid. Asam lemak adalah asam organik berantai panjang yang mempunyai atom karbon dari 4 sampai 24. Asam lemak memiliki gugus karboksil tunggal dan ekor hidrokarbon nonpolar yang panjang. Hal ini membuat kebanyakan lipid bersifat tidak larut dalam air dan tampak berminyak atau berlemak (Lehninger 1982).
Lipid secara umum dapat dibagi ke dalam dua kelas besar, yaitu lipid sederhana dan lipid kompleks. Yang termasuk lipid sederhana antara lain adalah: 1) trigliserida dari lemak atau minyak seperti ester asam lemak dan gliserol, contohnya adalah lemak babi, minyak jagung, minyak biji kapas, danbutter, 2) lilin yang merupakan ester asam lemak dari rantai panjang alkohol, contohnya adalahbeeswax, spermaceti, dan carnauba wax, dan 3) sterol yang didapat dari hidrogenasi parsial atau menyeluruh fenantrena, contohnya adalah kolesterol dan ergosterol (Scy Tech Encyclopedia 2008).
Lipid yang paling sederhana dan paling banyak mengandung asam lemak sebagai unit penyusunnya adalah triasilgliserol, juga sering disebut lemak, lemak netral, atau trigliserida. Jenis lipid ini merupakan contoh lipid yang paling sering dijumpai baik pada manusia, hewan, dan tumbuhan. Triasilgliserol adalah komponen utama dari lemak penyimpan atau depot lemak pada sel tumbuhan dan hewan, tetapi umumnya tidak dijumpai pada membran. Triasilgliserol adalah molekul hidrofobik nonpolar, karena molekul ini tidak mengandung muatan listrik atau gugus fungsional dengan polaritas tinggi (Lehninger 1982). Triasilgliserol terakumulasi di dalam beberapa area, seperti jaringan adiposa, dalam tubuh manusia dan biji tanaman, dan triasilgliserol ini mewakili bentuk penyimpanan energi. Lipid yang lebih kompleks berada dekat dan berhubungan dengan protein dalam membran sel dan partikel subselular. Jaringan yang lebih aktif mengandung lipid kompleks yang lebih banyak, contohnya adalah dalam otak, ginjal, paru-paru, dan darah yang mengandung konsentrasi fosfatida dalam jumlah tinggi pada mamalia (Scy Tech Encyclopedia 2008).
Lipid sebagai suatu senyawa memiliki sifat-sifat fisika dan kimia yang khas. Sifat-sifat fisika lipid antara lain terdapat pada warna, bau, kelarutan, polimorfisme, titik didih, dan indeks bias. Sifat-sifat kimia lipid meliputi reaksi-reaksi hidrolisis, oksidasi, dan esterifikasi. Zat warna dalam minyak terdiri dari zat warna alami dan hasil degradasi zat warna alami. Zat warna alami misalnya a dan ß karoten, santofil, klorofil, dan antosianin. Zat warna ini menyebabkan minyak berwarna kuning, kuning kecoklatan, kehijau-hijauan, dan kemerah-merahan (Winarno 1992).
Lemak atau bahan berlemak seperti lemak sapi, lemak babi, mentega, krim, susu bubuk, mempunyai bau seperti bau ikan yang sudah basi. Bau minyak alami berasal dari hasil urai asam-asam lemak atau komponen lain yang larut dalam minyak, seperti minyak sawit mempunyai bau yang khas karena adanya karoten (Montgomery et al 1993).
Kelarutan suatu zat dalam suatu pelarut ditentukan oleh kepolaran zat dan pelarut tersebut. Minyak dan lemak tidak larut dalam air, sedikit larut dalam alkohol, dan larut sempurna dalam kloroform. Sifat kelarutan minyak dan lemak digunakan untuk memisahkan minyak dari bahan yang mengandung minyak. Asam lemak rantai pendek dapat larut dalam air. Semakin panjang rantai asam lemak kelarutan dalam air semakin berkurang, asam lemak tidak jenuh lebih mudah larut dalam pelarut organik dibandingkan dengan asam lemak jenuh (Poedjiadi 1994).
TUJUAN
Praktikum ini bertujuan untuk mempelajari dan membandingkan sifat-sifat lipid melalui beberapa uji kualitatif untuk beberapa macam sampel lipid seperti minyak kelapa, lemak hewan, mentega, margarin, gliserol, asam palmitat dan asam stearat.
ALAT DAN BAHAN
Alat yang digunakan pada praktikum reaksi uji protein ini adalah tabung reaksi, pipet tetes, pipet volumetrik 5 mL, alat pengaduk, penangas air, labu erlenmeyer 100 mL, kertas saring, pembakar spiritus, dan sumbat karet. Sementara, bahan-bahan yang digunakan dalam praktikum ini adalah air, eter, kloroform, alkohol panas, alkohol dingin, alkali, asam encer, minyak kelapa, lemak hewan, mentega, margarin, gliserol, asam stearat, asam oleat, Kristal KHSO4, pereaksi Iod Hubl, HCl pekat, serbuk CaCO3, H2SO4, kolesterol, dan asam asetat anhidrat.
PROSEDUR PERCOBAAN
Uji kelarutan dilakukan dengan memasukkan 2 ml pereaksi ke dalam tabung reaksi lalu membubuhkan sedikit bahan percobaan kedalamnya. Tabung dikocok dan amati kelarutannya. Bahan pelarut yang digunakan adalah air, eter, kloroform, alkohol panas, alkohol dingin alkali, dan asam encer. Sementara bahan-bahan percobaan yang digunakan adalah minyak kelapa, lemak hewan, mentega, margarine, mentega, gliserol, dan asam stearat.
Uji Akrolein dilakukan dengan memasukkan sedikit Kristal KHSO4 ke dalam tabung lalu dibubuhkan3-4 tetes bahan percobaan. Tabung dipanaskan langsung diatas api dan asap akrolein yang muncul diperhatikan. Kemudian dibandingkan bau akrolein dengan bau SO2 yang terbang dari karbohidrat yang dipanaskan. Bahan uji yang digunakan adalah minyak kelapa, lemak hewan, gliserol, dan asam stearat.
Uji Ketidakjenuhan dilakukan dengan memasukkan 1 mL bahan percobaan ke dalam tabung reaksi lalu ditambahkan kloroform sebanyak 1 mL dan dikocok hingga larut. Kemudian Iod Hubl dibubuhkan sedikit demi sedikit sambil dikocok dan diamati perubahannya. Bahan-bahan yang diuji adalah minyak kelapa, minyak kelapa tengik, lemak hewan, mentega, margarin, dan asam oleat.
Uji Ketengikan dilakukan dengan memasukkan 5 ml bahan percobaan dan 5 ml HCL pekat kedalam labu Erlenmeyer 100 mL. Sebelumnya telah disediakan kertas floroglusinol dan sumbat karet. Serbuk CaCO3 dimasukkan ke dalam labung Erlenmeyer dan segera ditutup dengan sumbu karet, dengan posisi menjepit kertas floroglusinol yang dimasukkan tegak lurus ke dalam labu erlenmeyer menyentuh bahan percobaan. Kerta floroglusinol dibiarkan selama 10 -20 menit. Perubahan warna yang terjadi pada kertas diamati. Bahan yang diujikan adalah minyak kelapa tengik, minyak kelapa, lemak hewan dan mentega.
Uji Salkowski dilakukan dengan melarutkan beberapa milgram kolesterol dan 3 ml kloroform pada tabung reaksi. Selanjutnya ditambahkan asam sulfat pekat dengan volume yang sama, lalu tabung dikocok perlahan dan diamati perubahan warnanya.
Kedalam larutan kolesterol dan kloroform( hasil percobaan salkowski) ditambahkan 10 tetes asam asetat anhidrat dan 2 tetes asam sulfat pekat. Dikocok perlahan dibiarkan beberapa menit.
HASIL PENGAMATAN
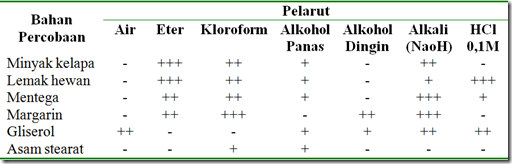
Tabel 1. Hasil uji kelarutan lipid
Gambar 1. Hasil uji kelarutan beberapa macam lipid pada air.
Gambar 2. Hasil uji kelarutan beberapa macam lipid pada alkohol dingin
Gambar 3. Hasil uji kelarutan beberapa macam lipid pada alkohol panas
Gambar 4. Hasil uji kelarutan beberapa macam lipid pada eter
Tabel 2. Uji Akrolein
| Nama Bahan | Pengamatan | Keterangan |
| Minyak kelapa | + | Bau SO2 |
| Lemak hewan | ++ | Bau akrolein |
| Gliserol | +++ | Bau akrolein |
| Asam stearat | ++ | Bau ekrolein |
| Ket : | + : Terdapat asap putih - : Tidak terdapat asap putih |
Tabel 3.Uji Ketidakjenuhan
| Nama Bahan | Pengamatan | Keterangan |
| Minyak kelapa | Kuning-merah-kuning | Tidak jenuh |
| Lemak hewan | Kuning-merah | Jenuh |
| Minyak kelapa tengik | Kuning-merah | Jenuh |
| Mentega | Kuning-merah-kuning | Tidak jenuh |
| Margarin | Kuning-merah-kuning | Tidak jenuh |
| Asam oleat | Kuning-merah-kuning | Tidak jenuh |
Gambar 5. Uji ketidakjenuhan pada minyak hewan, lemak hewan, minyak kelapa tengik, mentega, margarin, dan asam oleat berturut-turut dari kiri ke kanan.
Tabel 4. Uji Ketengikan
| Nama bahan | Pengamatan | Keterangan |
| Minyak kelapa tengik | +++ | Merah muda |
| Minyak kelapa | +++ | Merah muda |
| Lemak hewan | + | Jingga pudar |
| Mentega | ++ | Jingga terang |
| Ket : | + : Terjadi ketengikan - : Tidak terjadi ketengikan |
Tabel 5. Uji Salkowski
| Nama bahan | Perubahan Warna | Hasil uji |
| Kolesterol + (Kloroform dan H2SO4) | Degradasi 3 warna, merah pekat, jingga dan kuning | + |
| Ket : | + : Terdapat kolesterol - : Tidak terdapat kolesterol |
Gambar 7. Uji Salkowski dengan kloroform dan H2SO4.
Tabel 6. Uji Lieberman Buchard untuk kolesterol
| Nama bahan | Perubahan Warna | Hasil uji |
| Kolesterol + (Kloroform dan H2SO4) + asam asetat | Degradasi 4 warna, hijau pekat, merah pekat, jingga dan kuning | + |
| Ket: | + : Mengandung kolesterol - : Tidak mengandung kolesterol |
Gambar 8. Uji Lieberman Buchard untuk kolesterol
DAFTAR PUSTAKA
Lehninger AL. 1982. Dasar-Dasar Biokimia Jilid I (terjemahan). Jakarta: Erlangga.
Montgomery et al. 1993. Biochemistry: A Case Oriented Approach. The CV Mosby Company, St. Louis.
Poedjiadi Anna. 1994. Dasar-Dasar Biokimia. Jakarta: Penerbit UI-Press.
Scy Tech Encyclopedia. 2008. Lipid. (terhubung berkala). http://www.answers.com /library/Sci%252DTech %20 Encyclopedia-cid- 47286. html. (10 November 2010).
Winarno, F.G. 1992. Kimia Pangan dan Gizi. Jakarta: PT. Gramedia.


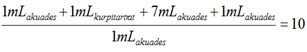
![clip_image002[4] clip_image002[4]](http://lh6.ggpht.com/-khqARCmhqks/Tx4TWpUlmHI/AAAAAAAAAvQ/Dj6aBM6u950/clip_image0024_thumb1.jpg?imgmax=800)











![clip_image002[7] clip_image002[7]](http://lh6.ggpht.com/-i6FSofcb3hM/Tx4bFaHa78I/AAAAAAAAAzQ/61X_NGftLo8/clip_image0027_thumb1.jpg?imgmax=800)
![clip_image006[5] clip_image006[5]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhquEq75bKeEhQM6j7E57aN37wtQxYEHsBu9JQHkMwtSAT_0rGhqJN27hKpLPB77A2Z_Ambfqfwr67Nz02ZoO7muNtMDXrPKtRenhf8n_dh0XbpAfO9U-NkkGJGYEIy6rdLYCnEySPMLXI/?imgmax=800)

![clip_image002[5] clip_image002[5]](http://lh5.ggpht.com/-heXco4Jfs70/Tx4SQr-EjTI/AAAAAAAAAtQ/hFWytRJcIbY/clip_image0025_thumb1.jpg?imgmax=800)




