Penentuan Kadar Glukosa Dalam Darah
Selasa, 24 Januari 2012 | Ayun
| Laporan Praktikum Biokimia Umum | Hari/tanggal : Selasa/21 Desember 2010 Waktu : 08.00 – 11.00 WIB PJP : Waras Nurcholis, M. Si Asisten : Resti Siti Mutmainah
|
PENENTUAN KADAR GLUKOSA DALAM DARAH
KELOMPOK 10
Randi Hadianta (G34090020)
Yovita Sari (G34090028)
Kurrataa’yun (G34090105)
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
2010
PENDAHULUAN
Glukosa, suatu gula monosakarida adalah salah satu karbohidrat terpenting yang digunakan sebagai sumber tenaga bagi hewan dan tumbuhan. Glukosa merupakan salah satu hasil utama fotosintesis dan awal bagi respirasi. Bentuk alami (D-glukosa) disebut juga dekstrosa, terutama pada industri pangan. Glukosa adalah suatu aldoheksosa dan sering disebut dekstrosa karena mempunyai sifat dapat memutar cahaya terpolarisasi ke arah kanan. Di alam, glukosa terdapat dalam buah-buahan dan madu lebah (Poedjiadi 1994).
Bila kadar gula dalam darah melebihi atau kurang dari batas normal maka sistem metabolisme dalam tubuh akan terganggu. Darah manusia normal mengandung glukosa dalam jumlah atau konsentrasi tetap, yaitu antara 70-100 mg tiap 100 ml darah. Glukosa darah ini dapat bertambah setelah kita makan makanan sumber karbohidrat, namun kira-kira 2 jam setelah itu, jumlah glukosa darah akan kembali pada keadaan semula. Salah satu contoh penyakit yang disebabkan oleh kelainan kadar glukosa yaitu diabetes mellitus. Diabetes mellitus atau yang lebih dikenal dengan kencing manis merupakan penyakit yang timbul karena suatu gangguan dari pankreas, yaitu organ tubuh yang biasa menghasilkan insulin dan sangat berperan dalam metabolisme glukosa bagi sel tubuh. Seseorang yang terkena diabetes mellitus selalu ditandai oleh naiknya kadar gula darah (hiperglikemia) dan tingginya kadar gula dalam urine (Achjadi 2003). Pada orang yang menderita diabetes mellitus atau kencing manis, jumlah glukosa darah lebih besar dari 130 mg per 100 ml darah (Poedjiadi, 1994).
Pada hewan terdapat salah satu penyakit yang dinamakan Hypocalcaemia. Hypocalcaemia adalah penyakit metabolisme pada hewan yang terjadi pada waktu atau segera setelah melahirkan yang manifestasinya ditandai dengan penderita yang mengalami depresi umum (Subronto 2001). Hypocalcaemia dapat menghambat ekskresi insulin sehingga pada kasus ini biasanya selalu diikuti kenaikan kadar glukosa. (Girindra 1988).
Glukosa darah dapat ditentukan dengan berbagai cara baik secara kimiawi maupun secara enzimatik. Prisip penentuannya didasari pada kemampuan glukosa untuk mereduksi ion anorganik seperti Cu2+ atau Fe(CN)63-. Penentuan glukosa secara reaksi reduksi kurang spesifik dibanding cara enzimatik, terutama bila dalam darah terdapat bahan yang dapat mereduksi misalnya kreatinin, asam urat dan gula-gula lain selain glukosa (manosa, galaktosa dan laktosa) yang akan memberikan hasil pemeriksaan yang lebih tinggi daripada kadar glukosa yang sebenarnya. Sebagai pedoman dapat diperkirakan bahwa hasil penentuan glukosa secara reduksi akan memberikan hasil 3,6 -10,8 mg % lebih tinggi daripada cara enzimatik. Perbedaan ini akan lebih besar lagi bila terdapat peningkatan kreatinin dan asam urat (Suryohudoyo & Purnomo 1996).
TUJUAN
Praktikum ini bertujuan untuk menentukan kadar gula pereduksi (glukosa) dalam darah dengan metode spektrofotometri.
ALAT DAN BAHAN
Alat-alat yang digunakan dalam praktikum ini adalah tabung reaksi, tabung erlenmeyer, pipet tetes, pipet volumetrik 10 mL, pipet volumetric 1 mL, penangas air, kertas saring, gegep, spekronik-20, dan tabung Folin Wu..
Bahan praktikum yang digunakan adalah darah, H2SO4 0,67 N, akuades, Na-Wolframat 10%, kupritartrat, larutan standar glukosa, dan larutan fosfolibdat.
PROSEDUR PERCOBAAN
Penentuan kadar glukosa dalam darah dilakukan dengan beberapa tahapan. Tahap awal dengan membuat filtrat penyaringan darah yang akan digunakan dalam pengukuran kadar. Pembuatan filtrat dilakukan dengan mencampurkan 1 mL darah, 7 mL akuades, dan 1 mL Na-Wolframat 10% di dalam tabung erlenmeyer kecil. Campuran tersebut pun dikocok dan ditetesi dengan 1 mL H2SO4 0,67 N secara perlahan. Selanjutnya hasil campuran tersebut didiamkan tanpa dikocok selama 10 menit yang kemudian disaring untuk mendapatkan filtratnya.
Pengujian dilakukan dengan beberapa perlakuan, yaitu perlakuan blanko, standar glukosa, dan tiga pengujian terhadap filtrat. Perlakuan blanko dimasukkan 1 mL akuades dengan 1 mL kupritartrat. Perlakuan standar glukosa didapatkan dengan mencampurkan 1 mL larutan standar glukosa dengan 1 mL kupritartrat. Sementara untuk filtrat didapatkan dengan mencampurkan 1 mL filtrat dengan 1 mL kupritartrat. Ketiga perlakuan tersebut dilakukan secara bersamaan (pada waktu yang sama). Ketiga jenis perlakuan tersebut dipanaskan dalam air mendidih selama 8 menit tepat. Perlakuan yang telah dipanaskan pun didinginkan dan diencerkan dengan menambahkan 7 mL akuades pada setiap perlakuan. Selanjutnya pada setiap tabung dimasukan mL fosfomolibdat pada waktu yang bersamaan untuk setiap perlakuan. Pengukuran pun dilakukan dengan menggunakan spektronik-20. Penggunaan spektronik-20 dilakukan dengan men-tera alat terlebih dahulu. Tera dilakukan dengan memasukkan larutan blanko ke dalam tabung pupet dan dimasukkan ke dalam spektronik, selanjutnya ditekan tombol ‘blank’. Kemudian dilakukan hal yang sama pada setiap perlakuan tanpa menekan tombol blank. Angka yang tertera pada spektronik-20 menunjukkan tingkat absorban larutan. Tingkat absorban larutan pun dicatat yang kemudian akan dihitung untuk menentukan kadar glukosa di dalam darah.
HASIL PENGAMATAN
Tabel 1. Penentuan kadar glukosa darah
| Larutan | Absorban | [glukosa darah] (mg/dL) | [glukosa darah]rata-rata (mg/dL) |
| Blanko | 0,000 | 0,000 | 53,732 |
| Standar glukosa | 0,451 | 10,000 | |
| Filtrat 1 | 0,276 | 61,197 | |
| Filtrat 2 | 0,260 | 57,650 | |
| Filtrat 3 | 0,191 | 42,350 |
Contoh perhitungan:
CStandar glukosa = 0,1 mg/mL = 10 mg/dL
Kadar glukosa darah (mg/dL) =

= 61,197 mg/dL
Kadar glukosa darah filtrat 2 (mg/dL) =
= 57,650 mg/dL
Kadar glukosa darah filtrat 3 (mg/dL) =
= 42,350 mg/dL
Kadar glukosa darah filtrat rata-rata (mg/dL) =
= 53,732 mg/dL

PEMBAHASAN
Uji glukosa darah pada praktikum ini menggunakan metode spektofotometri. Menurut (Syabatini 2010), spektrofotometri merupakan suatu metoda analisa yang didasarkan pada pengukuran serapan sinar monokromatis oleh suatu lajur larutan berwarna pada panjang gelombamg spesifik dengan menggunakan monokromator prisma atau kisi difraksi dengan detektor fototube. Spektrofotometer adalah alat untuk mengukur transmitan atau absorban suatu sampel sebagai fungsi panjang gelombang. Sedangkan pengukuran menggunakan spektrofotometer ini, metoda yang digunakan sering disebut dengan spektrofotometri. Spektrofotometri dapat dianggap sebagai perluasan suatu pemeriksaan visual dengan studi yang lebih mendalam dari absorbsi energi. Absorbsi radiasi oleh suatu sampel diukur pada berbagai panjang gelombangdan dialirkan oleh suatu perkam untuk menghasilkan spektrum tertentu yang khas untuk komponen yang berbeda.
Pembuatan filtrat dilakukan dengan memipet 1 ml darah ke dalam erlenmeyer kecil, serta ditambahkan 1 mL Na-wolframat 10%, dan 1 mL H2SO4 0,67 N tetes demi tetes. Fungsi penambahan akuades adalah mengencerkan darah sehingga albumin dalam darah akan larut oleh akuades. Menurut Poedjiadi (1994), albumin adalah protein yang dapat larut dalam air serta dapat terkoagulasi oleh panas. Albumin terdapat dalam serum darah dan putih telur. Penambahan Na-wolframat bertujuan mengendapkan albumin yang terlarut dalam air. H2SO4 berfungsi sebagai katalisator untuk mempercepat reaksi pengendapan albumin oleh Na-wolframat.
Larutan yang telah dibuat didiamkan selama 10 menit agar terjadi endapan albumin secara sempurna, sehingga ketika endapan tersebut dipisahkan dengan kertas saring akan memisah dengan sempurna. Selanjutnya tabung reaksi yang telah berisi masing-masing bahan, berturut-turut filtrat, standar glukosa, dan akuades ditambahkan 1 mL larutan kupritartrat. Penambahan larutan kupritartrat berfungsi dalam pembentukan warna biru ketika ditambahkan pereaksi fosfomolibdat. Hal tersebut dapat terjadi karena larutan kupritartrat mengandung asam laktat dan ion Cu+. Menurut Girinda (1989), pada penambahan kupritartrat, ion kupri akan direduksi oleh gula menjadi kupro dan mengendap sebagai Cu2O. Penambahan pereaksi fosfomolibdat kuprooksida melarut lagi dan warna larutan akan berubah menjadi biru tua disebabkan oleh adanya oksidasi Mo. Intensitaas warna larutan adalah ukuran banyaknya gula yang ada di dalam filtrat. Hasil percobaan ini sesuai dengan prinsip uji tauber yang memberikan hasil positif (warna biru) pada larutan yang mengandung monosakarida (glukosa).
Selanjutnya ketiga tabung tersebut dipanaskan dengan air mendidih selama 8 menit tepat. Pemanasan berfungsi menambah laju reaksi oleh kupritartat. Ketiga tabung tersebut didinginkan, lalu diencerkan dengan 7 ml akuades. Sebanyak 1 mL larutan fosfomolibdat ditambahkan pada setiap tabung. Penambahan H2SO4 0,67 N bertujuan untuk menciptakan suasana asam, karena reaksi dengan fosfomolibdat terjadi pada suasana asam. Perubahan warna yang terjadi diamati dan intensitas warnanya diamati dengan spektronik-20 pada panjang gelombang 660 nm.
Pengamatan dengan spektronik-20 menggunakan prinsip hukum Lambert Beer. Suatu spektrofotometer tersusun dari sumber spektrum sinar tampak yang sinambung dan monokromatis. Sel pengabsorbsi untuk mengukur perbedaan absorbsi antara cuplikan dengan blanko ataupun pembanding. Adapun penggunaan panjang gelombang sebesar 660 nm disebabkan karena panjang gelombang maksimum untuk transmitansi larutan glukosa adalah 660nm (Syabatini 2010).
Hasil pengukuran kadar glukosa dalam darah yang telah dilakukan pada praktikum ini menunjukkan bahwa larutan standar glukosa memiliki kadar glukosa 10 mg/dL (sesuai dengan literatur). Larutan blanko yang merupakan campuran dari kupritartrat dan akuades memiliki kadar glukosa 0,000 mg/dL. Sementara kandungan glukosa dalam darah setelah dirata-ratakan dari ketiga pengulangan adalah 53,372 mg/dL. Sehingga dapat diketahui bahwa yang digunakan dalam praktikum adalah darah ayam.
Kadarglukosa darah normal 50 –100 /dL ( 50/18 –100/18 mmol/dL ). Hepar mempertahankan glukosa dengan glikogenolisis dan glukoneogenesis, dibawah kontrol hormonal (glukagon atau kalau turunnya drastis menjadi epinefrin). Apabila glukosa darah turun, glukagon dilepas pankreas,glukagon akan mengaktifkan adenilil siklase, enzim ini akan mengkatalisis pembentukan cAMP dari ATP, cAMP akan mengaktifkan cAMP dependent protein kinase, yang selanjutnya akan mengubah fosforilase kinase b a (dengan fosforilasi membutuhkan ATP). Fosforilase kinase a akan mengaktifkan fosforilase (fosforilase fosforilase-P). Selanjutnya fosforilase yang aktif memecah glikogen menghasilkan G 1P. Bersama dgn enzim glukantransferase dan debrancing enzim glikogen akan dipecah semuanya.
Bila kadar gula dalam darah melebihi atau kurang dari batas normal maka sistem metabolisme dalam tubuh akan terganggu. Salah satu contoh penyakit yang disebabkan oleh kelainan kadar glukosa yaitu diabetes melitus. Terdapat dua jenis penyakit diabetes melitus yaitu diabetes melitus tipe 1 (insulin-dependent diabetes mellitus) yaitu kondisi defisiensi produksi insulin oleh pankreas. Kondisi ini hanya bisa diobati dengan pemberian insulin. Diabetes melitus tipe 2 (non-insulin-dependent diabetes mellitus) yang terjadi akibat ketidakmampuan tubuh untuk berespons dengan wajar terhadap aktivitas insulin yang dihasilkan pankreas (resistensi insulin), sehingga tidak tercapai kadar glukosa yang normal dalam darah. Diabetes melitus tipe 2 ini lebih banyak ditemukan dan diperkirakan meliputi 90% dari semua kasus diabetes di seluruh dunia (Suryohudoyo 1996).
Selain diabetes, penyakit yang diakibatkan ketidakseimbangan glukosa adalah polyuria. Menurut Dorland (2002), Polyuria adalah kondisi dimana ekskresi urin yang besar atau berlebihan dalam periode tertentu. Sedangkan diabetes adalah adanya berbagai gangguan yang ditandai dengan polyuria. Polifagia terjadi akibat jaringan tubuh tidak mendapatkan suplai glukosa yang cukup akibat gagalnya insulin membuka kanal glukosa. Akibatnya, glukosa darah menumpuk, namun tubuh tetap merasa lapar. Karena glukosa tidak dapat mencukupi kebutuhan energi jaringan, maka tubuh mengambil energi tersebut dari sumber energi yang lain, seperti lemak atau protein, sehingga lama kelamaan pasien menjadi semakin kurus. Selanjutnya, karena ginjal mempunyai ambang batas tertentu terhadap filtrasi glukosa, maka glukosa ikut lolos sehingga keluar bersama urin. Karena itu pengujian urin untuk glukosa reduksi mempunyai hasil posisitif (+++). Untuk menjaga agar urin tidak terlalu pekat, ginjal mempunyai sistem pengaturan sendiri, sehingga cairan tubuh ikut keluar bersama urin, dan jaringan tubuh mengalami dehidrasi. Sebab itu, penderita DM pada umumnya merasa sering haus (polidipsi). Gejala klinis berupa polineuropati dan retinopati berkaitan dengan akumulasi fruktosa dan sorbitol. Secara umum, penumpukan fruktosa dan sorbitol mengganggu kerja sistem saraf, namun secara khusus keduanya jelas terlibat dalam patogenesis katarak diabetika. Kadar kreatinin dan hasil uji protein urin yang abnormal juga menunjukkan salah satu komplikasi DM, yaitu defisiensi kerja ginjal. Ginjal tidak mampu menyaring protein dengan baik, sehingga protein ikut terlarut dalam urin. Adanya kalsifikasi pada pankreas menunjukkan terganggunya fungsi pankreas dalam memproduksi insulin dalam jumlah normal.
KESIMPULAN
Kadar gula pereduksi dalam darah dapat dilakukan dengan uji spektofotometri. Hasil uji kadar gula dalam darah sampel yaitu 53,732mg/dL. Pengetahuan tentang kadar gula dalam darah sangat penting untuk metabolisme tubuh.
DAFTAR PUSTAKA
Achjadi K. 2003. Penyakit Gangguan Metabolisme. Bogor : IPB Press.
Dorland W.A Newman. 2002. Kamus Kedokteran Dorland Edisi 29. Jakarta: EGC.
Girindra A.1988. Biokimia I. Jakarta : Gramedia
_________.1989. Biokimia Patologi. Bogor: IPB Press.
Poedjiadi Anna 1994. Dasar-dasar Biokimia. Jakarta: UI Press.
Subronto. 2001. Ilmu Penyakit Ternak II. Yogyakarta : Gadjah Mada University Press.
Suryohudoyo P & Purnomo SU. 1996. Dasar Molekuler Diabetes Mellitus (DM), Naskah Lengkap Surabaya Diabetes Update-I : 71-73.
Syabatini Annisa. 2010. Analisis Campuran Dua Komponen Tanpa Pemisahan Dengan Spektrofotometer. Pontianak : UNLAM Press.

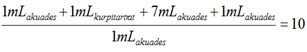
1 comments:
terima kasih sudah memposting hasil percobaan anda yang bermanfaat bagi saya
Posting Komentar