Biofisik (2)
Minggu, 15 Januari 2012 | Ayun
PENDAHULUAN
Larutan merupakan bentuk materi yang terlihat biasa, sehingga pemahaman perilaku mereka menambah pengetahuan kita mengenai dunia di sekitar kita. Perilaku kimia suatu larutan bergantung pada pelarut dan zat terlarut khas yang terlibat, sedangkan perilaku fisiknya dapat diramalkan berdasarkan beberapa hukum seperti titik beku dan titik didih, tekanan uap, dan tekanan osmosis.
Erat berhubungan dengan larutan adalah pengkajian keadaan koloid. Keadaan koloid adalah suatu keadaan subdivisi yang terletak antara suatu larutan dan suatu suspense. Partikel-partikel dalam suatu disperse koloid terlalu besar untuk dianggap benar-benar terlarut, tetapi partikel-partikel ini begitu kecil sehingga tidak mengendap seperti partikel suspensi (Keenan et al. 1980).
Materi koloid dapat dihamburkan atau disebarkan dalam suatu medium sinambung, sehingga dihasilkan suatu disperse (sebaran) Koloid atau sistem koloid. Sistem koloid memiliki beberapa sifat, yaitu Efek Tyndall, Gerak Brown dan Adsorpsi (Keenan et al. 1980).
Bufer atau sering disebut sebagai larutan penyangga, yaitu larutan yang dapat mempertahankan harga pH tertentu terhadap usaha penambahan asam basa atau pengenceran. Biasanya larutan ini digunakan untuk keperluan praktikum dan mempertahankan pH dalam tubuh (Purba 2003)
Osmosis merupakan suatu sifat aliran zat cair untuk menyamakan konsentrasi air pada kedua belah pihak dari selaput membrane semipermeabel. Sifat osmosis memiliki tekanan yang disebut tekanan osmosis. Tekanan osmosis didefiniskan sebagai tekanan yang harus digunakan kepada suatu larutan untuk menghindari transfer netto apapun dari pelarut murni (pada tekanan 1 atm) ke dalam larutan itu lewat suatu membrane semipermeabel. Jika tekanan mekanis pada suatu larutan melebihi tekanan osmosis, pelarut murni akan terperas ke luar dari suatu larutan lewat suatu membrane semipermeabel. Proses ini disebut osmosis terbalik (reverse osmosis) (Keenan et al. 1980).
TUJUAN
Praktikum ini bertujuan untuk mengamati koloid liofil dan liofob, pengendapannya oleh garam, membuat buffer asetat dan fosfat dalam berbagai tingkatan pH, serta mengamati tekanan osmotik cairan sel darah merah.
METODE PRAKTIKUM
Praktikum Biofisik 2 ini dilakukan di Lab. Bio 1 pada hari Selasa, 28 September 2010, pukul 08.00 – 11.00 WIB.
Praktikum terdiri dari tiga tahap utama. Pada tahap awal dilakukan percobaan Koloid. Koloid yang akan diuji ialah koloid Liofil dan koloid liofob. Koloid liofil terdiri dari 2 bahan, yakni gelatin dan pati. Untuk koloid gelatin 2%, disiapkan gelas piala 250ml lalu dicampurkan 2g gelatin dan 25 ml akuades dingin. Kemudian tuang 75 ml air mendidih dan aduk. Sedangkan untuk koloid pati 2%, disiapkan pula gelas piala 250 ml, lalu dimasukan 2 g pati dan 10 ml air dingin. Kemudian tuang air 90ml air mendidih lalu diaduk lagi.
Selanjutnya, materi kedua ialah koloid Liofob. Koloid Liofob terdiri dari 2 bahan yaitu Biru Berlin dan Ferihidroksida. Untuk koloid biru berlin, dipipet K4Fe(CN)6 0,2 N 10 ml dengan FeCl3 0.02 N pada gelas piala 100ml, diaduk hingga homogen. Ambil kira kira 5 ml campuran tadi ke tabung reaksi, diencerkan seperlunya. Diamati ada endapan atau tidak. Untuk koloid ferihidroksida, dipipet FeCl3 33% 1 ml, dan ditambahkan kedalam 200 ml akuades mendidih dalam gelas piala. Koloid yang telah jadi diamati dan dicatat perbedaannya.
Kemudian, dilakukan percobaan pengendapan koloid dengan larutan garam. Untuk pengendapan koloid liofil NaCl 10%, ditambahkan beberpa ml larutan NaCl 10% hingga terbentuk endapan. Akuades ditambahkan bila larutan jenuh dan jika larutan tidak terbentuk endapan, ditambahkan MgSO4. Untuk pengendapan koloid liofiob larutan garam, pada koloid liofob ditambahkan beberapa larutan NaCl 10% hingga ada endapan, diamati hingga 1 jam. Unutk sifat larutan koloid, disiapkan gelatin 15 % kemudian dimasukkan 5 ml ke dalam 4 tabung reaksi, didinginkan hingga berbentuk gel. Disiapkan larutan koloid CuSO4 5%, koloid biru berlin, eosin dan larutan giemsa. Didinginkan satu malam, lalu diamati larutan mana yang berdifusi lewat gel dan mana yang tidak. Difusi dengan perembesan dibedakan.
Untuk tahap kedua ialah percobaan mengenai Buffer. Percobaan ini mengenai tata cara pembuatan buffer dari berbagai pH. Yang pertama ialah Buffer standar asetat (Walpole). Dicampurkan larutan 0.1 N asam asetat dan Na-asetat dengan perbandingan antara keduanya sebagai berikut : 46,25 : 3,75 l; 41,00 : 9,00; 31,50 : 18,50; 20,00 : 30,00; dan 10,50 : 39.50. Setelah dicampurkan dan homogen, dukur pH nya dan catat hasilnya. Yang Buffer fosfat standar ( Sorensen) dicampurkan, 1/15 M Na2HPO4 DAN KH2PO4 dengan perbandingan dengan perbandingan sebagai berikut : 2,50 : 47,50; 6,00 : 44,00; 13,25 : 36,75; 25,00 : 25,00; dan 35,75 : 14,25. pH Larutannya diukur dan dicatat.
Tahap terakhir Percobaan tekanan Osmotik, yang diukur ialah tekanan osmotik cairan sel darah merah ayam. Tiga tabung reaksi disediakan untuk dimasukan masing – masing kurang lebih 5ml larutan NaCl 0,3%, 0,9% dan 5 %. Kemudian darah segar diteteskan dan disuspensikan dengan larutan NaCl tadi. Kemudian diamati di mikroskop.
HASIL DAN PEMBAHASAN
Tabel 1. Pengendapan koloid dengan larutan garam
| Tipe Koloid | Koloid Pengamatan |
| Liofil | Gelatin ++ |
| Pati ++ | |
| Liofob | Biru berlin +++ |
| Ferihidroksida +++ |
Ket:
| - : tidak ada endapan + : endapan sedikit | ++ : endapan cukup banyak +++: endapan sangat banyak |
| Gambar 1. Endapan pada liofil | Gambar 2. Endapan pada liofob |
Tabel 2. Difusi Melalui Gel
| Larutan | Hasil |
| CuSO4 5% | Perembesan |
| Eosin | Difusi |
| Giemsa | Difusi sedikit |
| Biru berlin | Perembesan |
| Gambar 3. CuSO4 | Gambar 4. Eosin | Gambar 5. Giemsa | Gambar 6. Biru berlin |
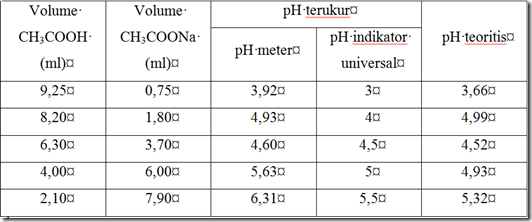
Tabel 3. Bufer Asetat (Walpole)
Tabel 4. Bufer Phospat
| Volume Na2HPO4 (ml) | Volume KH2PO4 (ml) | pH terukur | pH teoritis | Kapasitas Bufer | |
| pH meter | pH indikator universal | ||||
| 0,5 | 9,5 | 5 | 5,51 | 0,76 | |
| 1,2 | 8,8 | 6 | 5,93 | 0,83 | |
| 2,65 | 7,35 | 6 | 6,36 | 0,883 | |
| 5 | 5 | 7 | 6,8 | 0,94 | |
| 7,5 | 2,85 | 7 | 7,23 | 1,00 |
· Tabel 5. Tekanan Osmotik Sel Darah Merah
| Larutan | Hasil | Pengamatan |
| NaCl 3% | 10 x 10 Gambar 7. Sel darah dengan NaCl 3% | Hipotonik Sel menggelembung dan pecah |
| NaCl 9% | 40 x 10 Gambar 8. Sel darah dengan NaCl 9% | Isotonik Sel darah tetap utuh |
| NaCl 5% | 10 x 10 Gambar 9. Sel darah dengan NaCl 5% | Hipertonik Sel darah mengkerut |
Gambar 10. Larutan Darah dengan kadar NaCl berturut-turut 0,3%; NaCl 0,9%, dan 5% (dari kiri ke kanan)
Pada percobaan pengendapan koloid dengan larutan garam didapatkan bahwa kedua jenis koloid, yaitu koloid liofil dan koloid liofob mengalami pengendapan. Koloid liofil (campuran pati dan gelatin) belum mengalami reaksi (pengendapan) ketika ditambahkan NaCl, namun ketika ditambahkan lagi dengan MgSO4, koloid mengalami pengendapan. Berbeda halnya dengan koloid liofob. Koloid liofob (campuran biru berlin dan ferihidroksida) mengendap setelah satu jam ditambahkan NaCl. Biru berlin menghasilkan endapan berwarna biru pekat di bawahnya sedangkan ferihidroksida menghasilkan endapan bewarna jingga pekat. Pengendapan tersebut terjadi karena koloid mempunyai partikel yang bermuatan sejenis sehingga antar pertikelnya saling tolak menolak.
Beberapa partikel koloid dapat menyerap banyak ion dari larutan dan menjadi bermuatan listrik dalam pembentukannya. Walaupun faktor muatan listrik penting untuk menstabilkan koloid, konsentrasi ion yang tinggi dapat menyebabkan koagulasi atau pengendapan koloid. Ion yang menyebabkan hal ini adalah ion yang muatannya berlawanan dengan partikel tersebut. Semakin tinggi muatan kation, semakin efektif untuk mengendapkan koloid (Petrucci, 1985). Menurut Oxtoby (2001), garam dapat mengurangi gugus elektrostatik di antara partikel yang tersuspensi sehingga menyebabkan agregasi dan pengendapan. Bila garam ditambahkan pada disperse koloid, gaya tolak di antara partikel koloid akan berkurang dan terjadi agregasi.
Pada percobaan pengamatan sifat-sifat koloid (difusi melalui gel), dapat ditentukan larutan yang termasuk koloid liofil atau liofob melalui kemampuan larutan berdifusi. Larutan CuSO4, giemsa, dan eosin dapat berdifusi melalui gel, sehingga termasuk koloid liofil. Sedangkan biru berlin tidak berdifusi melalui gel atau merembes sehingga disebut koloid liofob (tabel 2). Hal tersebut dapat dikarenakan sifat kandungan-kandungan pada larutan-larutan tersebut.
Giemsa merupakan salah satu stain yang sering digunakan dalam pewarnaan sel. Giemsa mengandung ikatan adenin-timin. Eosin atau C20H8Br4O5 merupakan pewarna merah neon yang diperoleh dari reaksi brom pada fluorescein yang dapat digunakan sebagai sebagai toner; juga: merah untuk natrium coklat atau garam kalium yang digunakan sebagai pewarna biologis untuk struktur sitoplasma. Sebagaimana halnya Geimsa dan Eosin, biru berlin merupakan salah satu zat pewarna yang sering digunakan untuk pewarnaan.
Kapasitas bufer/daya tahan campuran adalah jumlah mol asam atau basa kuat yang harus ditambahkan ke dalam 1L campuran penahan agar terjadi perubahan pH sebesar 1 satuan. Hasil percobaan pengukuran pH bufer asetat dengan cara Walpole menunjukkan bahwa kapasitas bufer terbesar dapat diperoleh dengan mencampurkan Na-asetat dengan asam asetat. Jumlah Na-asetat dengan asam asetat yang dicampurkan dilakukan pada 5 ulangan yang berbeda (tabel 3). Hasil pengukuran antara pH meter dan pH universal tidak berbeda jauh. Adanya perbedaan hasil pengukuran sekitar 2 digit di depan koma dikarenakan penggunaan pH universal hanya mengandalkan warna yang dibandingkan antara pH 1 – 7. Berbeda dengan pH meter yang lebih akurat dan tepat. Perbedaan juga dapat diakibatkan kesalahan pengamatan. Sementar itu, Perbandingan konsentrasi asam-basa lemah dengan garamnya menentukan efektifitas larutaan bufer. Pada bufer asetat, semakin banyak volume Na-asetat yang ditambahkan, semakin naik pula pHnya. Dari data, terlihat bufer asetat efektif pada pH sekitar 5.0, artinya setelah mencapai pH 5.0, penambahan volume Na-asetat akan meningkatkan pH, tetapi tidak terlalu besar. Berbeda dengan bufer asetat, bufer fosfat tidak terlalu efektif, karena penambahan KH2PO4 meningkatkan pH larutan terlalu besar. Dari data pengamatan pH efektif untuk bufer fosfat adalah sekitar 6.0. Di dalam tubuh sendiri sistem bufer bikarbonat mempertahankan pH darah sekitar 7.40 (Purba 2003).
Tekanan osmotik adalah tekanan yang diberikan pada suatu larutan untuk mencegah penambahan isinya jika dipisahkan oleh suatu membran semipermeabel. Percobaan pengamatan tekanan osmotik pada sel darah merah ayam (tabel 5) menunjukkan bahwa sel darah merah pecah (tidak terlihat) ketika ditambahkan larutan NaCl 0,3% (Gambar 7). Hal ini terjadi karena larutan NaCl 0,3% membuat lingkungan di luar sel menjadi hipotonik. Penambahan larutan NaCl 5% (Gambar 9) pada sel darah merah akan menjadikan lingkungan di luar sel menjadi hipertonik. Hipertonik dikarenakan konsentrasi dalam sel lebih besar dibandingkan konsentrasi di luar sel sehingga menyebabkan air berdifusi ke luar sel, dan sel terlihat agak mengkerut (Soemartono, 1975). Sementara itu sel darah merah ayam terlihat normal ketika ditambahkan larutan NaCl 0,9% (Gambar 8.). Hal itu dkarenakan tekanan osmotik di dalam dan di luar sel sama atau disebut juga isotonik. Menurut Keenan (1980), larutan yang tekanan osmotiknya sama dengan darah disebut larutan isoton; yang lebih rendah daripada darah disebut larutan hipoton; dan yang lebih tinggi disebut larutan hiperton. Bila suatu larutan yang akan disuntikkan ke dalam aliran darah dirumuskan, tekanan osmosis larutan itu harus diperhatikan. Tekanan osmosis rata-rata darah berkisar pada 7,7 atm (naik setelah makan dan kemudian turun lagi). Jika sel darah merah ditaruh dalam suatu larutan yang tekanan osmosisnya lebih tinggi daripada tekaan osmosis darah yang normal, air akan keluar dari sel-sel itu sehingga sel akan mengkerut dan mengendap. Jika sel ditaruh dalam larutan yang tekanan osmosisnya lebih rendah daripada darah, sel itu akan membengkak karena menyerap air sampai dinding selnya pecah (lisis). Akibatnya tekanan osmosis larutan injeksi harus disesuaikan (terutama dengan natrium klorida) agar dapat dicampur dengan darah (Keenan et al. 1980).
KESIMPULAN
Perbedaan koloid liofob dan liofil adalah kemampuan mereka untuk menarik air, koloid liofil dapat menarik air dengan baik sedangkan koloid liofob tidak dapat menarik air sama sekali. Larutan bufer adalah larutan untuk mempertankan nilai pH. Ukuran larutan bufer yang baik apabila berkisar antara 0 sampai 1. Di dalam tubuh sistem bufer bikarbonat digunakan untuk mempertahankan nilai pH darah. Berkaitan dengan itu, sel darah merah memiliki tekanan osmotik yang sama dengan NaCl 0,9%. Apabila ditambah dengan larutan yang lebih pekat akan terjadi peristiwa hipertonik dan apabila di tambah dengan larutan yang lebih encer akan terjadi peristiwa hipotonik.
DAFTAR PUSTAKA
Keenan CW et al. 1980. Kimia Untuk Universitas (terjemahan). Jakarta: Erlangga.
Oxtoby DW. 2001. Kimia Modern. Edisi ke-4 Jilid 1. Suminar SA, penerjemah. Jakarta: Erlangga. Terjemahan dari : Principles of Modern Chemistry.
Pettrucci RH. 1985. Kimia Dasar: Prinsip dan Terapan Modern Jilid 2. Sumisar SA, penerjemah. Jakarta: Erlangga. Terjemahan dari : General Chemistry: Principles and Modern Applications. Fourth Edition.
Purba M. 2003. Kimia 2000. Jakarta: Erlangga.













0 comments:
Posting Komentar