Enzim
Minggu, 22 Januari 2012 | Ayun
| Laporan Praktikum Biokimia Umum | Hari/tanggal : Selasa/23 November 2010 Waktu : 08.00 – 11.00 WIB PJP : Waras Nurcholis, M.Si Asisten : 1. Resti Siti Muthmainah 2. Nuril Izzatul W. |
ENZIM
KELOMPOK 10
Randi Hadianta (G34090020)
Yovita Sari (G34090028)
Kurrataa’yun (G34090105)
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
2010
---------------------------------------------------------------------------------------------------------
PENDAHULUAN
Enzim adalah golongan protein yang paling banyak terdapat dalam sel hidup dan mempunyai fungsi penting sebagai katalisator reaksi biokimia yang secara kolektif membentuk metabolism perantara (intermediary metabolism) dari sel (Wirahadikusumah 1977).
Menurut Aisjah (1986) berdasarkan strukturnya, enzim terdiri atas komponen yang disebut apoenzim yang berupa protein dan komponen lain yang disebut gugus prostetik yang berupa nonprotein. Gugus prostetik dibedakan menjadi koenzim dan kofaktor. Koenzim berupa gugus organik yang pada umumnya merupakan vitamin, seperti vitamin B1, B2, NAD+ (Nicotinamide Adenine Dinucleotide). Kofaktor berupa gugus anorganik yang biasanya berupa ion-ion logam, seperti Cu2+, Mg2+, dan Fe2+. Beberapa jenis vitamin seperti kelompok vitamin B merupakan koenzim. Jadi, enzim yang utuh tersusun atas bagian protein yang aktif yang disebut apoenzim dan koenzim, yang bersatu dan kemudian disebut holoenzim.
Saliva adalah cairan eksokrin yang terdiri dari 99% air, berbagai elektrolit yaitu sodium, potasium, kalsium, kloride, magnesium, bikarbonat, fosfat, dan terdiri dari protein yang berperan sebagai enzim, immunoglobulin, antimikroba, glikoprotein mukosa, albumin, polipeptida dan oligopeptida yang berperan dalam kesehatan rongga mulut. Saliva terdiri dari 99,5% air dan 0,5% subtansi yang larut. Beberapa komposisi saliva adalah protein (mucoid, enzim, protein serum, waste product), ion-ion organik, gas, dan zat-zat aditif di rongga mulut (Suharsono 1986).
TUJUAN
Percobaan ini bertujuan untuk mengetahui sifat dan susunan air liur, pengaruh suhu dan pH pada aktifitas amilase air liur, serta mengetahui hidrolisis pati matang dan mentah oleh amilase air liur.
ALAT DAN BAHAN
Alat-alat yang digunakan dalam praktikum ini adalah tabung reaksi, gelas piala, pipet tetes, pipet volumetrik, dan pemanas air, kertas saring, karet penyumbat, tabung erlenmeyer, urinometer, glass wool, dan porselen.
Bahan praktikum yang digunakan adalah lakmus PP, lakmus MO, pereaksi Biuret, pereaksi Molisch, pereaksi millon, klorida, sulfat, fosfat, pereaksi musin, HCl, asam asetat, akuades, Na2CO3, pereaksi iodium encer, pereaksi benedict, air liur, larutan pati/kanji 1%.
PROSEDUR PERCOBAAN
Pada percobaan pertama, yaitu sifat dan susunan air liur. Hal pertama yang dilakukan adalah mengumpulkan air liur sebanyak 50 ml. Kemudian disaring dengan menggunakan kertas saring dan glass wool pada tabung erlenmeyer. Pengujian pertama yaitu menentukan bobot jensnya dengan urinometer, lalu uji reaksi dengan lakmus PP dan lakmus MO, diuji juga dengan pereaksi Biuret, dan pereaksi millon untuk mengetahui adanya protein, dan pereaksi Molisch untuk uji karbohidrat. Uji dilakukan juga terhadap klorida, sulfat, dan fosfat untuk menuji adanay mineral yang terkandung dalam air pati. Dan untuk mengetahui adanya endapan putih diberikan pereaksi musin pada 2 ml air liur.
Percoban kedua, pengaruh suhu pada aktifitas amilase enzim. Pertama-tama siapkan empat tabung reaksi, diisi dengan 2 ml ar liur dan 2 ml akuades, larutan tersebut dikocok dengan baik, lalu tabung pertama disimpan pada penangas air bersuhu 10°C, tabung kedua pada suhu kamar, tabung ketiga pada suhu 37°C, dan tabung keempat pada suhu 80°C selama 15 menit. Kemudian masing-masing tabung ditambah dengan 2 ml larutan kanji 1%, dikocok dengan baik, dan diletakkan pada kondisi suhu selama 10 menit. Uji dengan pereaksi iodum encer dan pereaksi benedict.
Percobaan ketiga, pengaruh pH pada aktifitas amilase air liur. Pertama-tama siapkan empat tabung reaksi, lalu tabung pertama diisi dengan 2 ml HCl, tabung kedua dengan 2 ml asam asetat, tabung ketiga dengan 2 ml akuades, dan tabung keempat dengan 2 ml Na2CO3. Masing-masing tabung ditambah dengan 2 ml larutan kanji 1%, adan 2 ml air liur, dkocok dengan baik, dan diletakkan pada penangas air bersuhu 37°C selama 15 menit. Dan diuji dengan pereaksi iodium dan benedict.
Percobaan keempat, hidrolisis pati matang oleh amilase air liur. Pada tabung diisi 3 ml larutan pati atau kanji 1% dan air liur yang telah disaring sebanyak 0,2 ml atau 4 tetes lalu dikocok. Masukkan ke penangas air bersuhu 37°C. Setiap 1 menit ambil 1 tetes larutan tersebut ke porselen untuk diuji dengan pereaksi iodum encer. Lihat perbedaan warna yang ditimbulkan pada setiap menit dan catat pada menit keberapa timbul warna biru, coklat, dan kapan tidak ada perubahan warna lagi. Setelah diuji dengan iodium telah menghasilkan positif, yaitu menjadi warna kuning (tidak ada perubahan warna atau adanya titik akromatik) diuji dengan pereaksi benedict.
Percobaan kelima, hidrolisis pati mentah oleh amilase air liur. Tabung diberi sedikit tepung pati, lalu ditambah dengan 5 ml akuades dan dikocok. Tambahkan 10 tetes air liur, simpan pada penangas air bersuhu 37°C selama 20 menit. Kemudian disaring dan diuji filtratnya terhadap produksi hidrolisis pati oleh amilase seperti pada percobaan keempat, yaitu Lihat perbedaan warna yang ditimbulkan pada setiap menit dan catat pada menit keberapa timbul warna biru, coklat, dan kapan tidak ada perubahan warna lagi. Setelah diuji dengan iodium telah menghasilkan positif, yaitu menjadi warna kuning (tidak ada perubahan warna atau adanya titik akromatik) diuji dengan pereaksi benedict. Kemudian hasilnya dibandingkan.
HASIL PENGAMATAN
Tabel 1. Sifat fisik dan susunan air liur
| Uji | Hasil Pengamatan | Keterangan |
| Bobot Jenis | 1,010 gr/mm | BJ air liur>BJ alat |
| Lakmus | Merah | Asam |
| FF | Putih | + |
| MO | Jingga | + |
| Biuret | Violet | + |
| Millon | Gumpalan Kuning | + |
| Molisch | Violet | + |
| Musin | Endapan putih | + |
| Klorida | Endapan putih | + |
| Sulfat | Endapan putih | + |
| Fosfat | Hijau kekuningan | - |
| Ket : | + : Positif - : Negatif |
Contoh perhitungan:
| FK | = 2,333 x 10-3 = 0,002 |
| BJ terkoreksi | = BJ terbaca + FK = 1,008 + 0,002 = 1,010 gr/mm |
Tabel 2. Pengaruh suhu pada aktivitas amilase air liur
| Nomor Tabung | Uji Iod | Uji Benedict |
| 1 | (-) Bening Ungu | (+) terdapat endapan merah |
| 2 | (-) Bening hijau kekuningan | (+) terdapat endapan merah |
| 3 | (-) Bening kuning | (+) terdapat endapan merah |
| 4 | (+) Biru pekat | (-) tidak terdapat endapan merah |
| Ket : | + : Positif - : Negatif |

Gambar 6. Hasil uji iod pada suhu 10oC, 27oC,37oC, dan 80oC.

PEMBAHASAN
Tubuh manusia menghasilkan berbagai macam enzim yang tersebar di berbagai bagian dan memiliki fungsi tertentu. Salah satu enzim yang penting dalam sistem pencernaan manusia adalah enzim amilase. Enzim ini terdapat dalam saliva atau air liur manusia. Saliva yang disekresikan oleh kelenjar liur selain mengandung enzim amilase juga mengandung 99,5% air, glikoprotein, dan musin yang bekerja sebagai pelumas pada waktu mengunyah dan menelan makanan. Amilase yang terdapat dalam saliva adalah α-amilase liur yang mampu membuat polisakarida (pati) dan glikogen dihidrolisis menjadi maltosa dan oligosakarida lain dengan menyerang ikatan glikosodat α(1 4). Amilase liur akan segera terinaktivasi pada pH 4,0 atau kurang sehingga kerja pencernaan makanan dalam mulut akan terhenti apabila lingkungan lambung yang asam menembus partikel makanan.
Saliva adalah cairan yang lebih kental daripada air biasa dan mengandung enzim amilase. Hal ini sesuai dengan hasil pengamatan air liur (saliva) yang menunjukkan bahwa saliva memiliki bobot jenis lebih besar daripada air, yaitu 1.008 g/mL.
Uji lakmus tidak dilakukan pada praktikum kali ini. Namun, menurut Amerongen (1991), rata-rata pH air liur normal yaitu 6,8, yaitu bersifat asam. Sehingga jika diuji dengan lakmus merah, warna lakmus akan tetap berwarna merah. Lakmus adalah asam lemah. Lakmus memiliki molekul yang sungguh rumit yang akan kita sederhanakan menjadi HLit. "H" adalah proton yang dapat diberikan kepada yang lain. "Lit" adalah molekul asam lemah. Tidak dapat dipungkiri bahwa akan terjadi kesetimbangan ketika asam ini dilarutkan dalam air.
Lakmus yang tidak terionisasi adalah merah, ketika terionisasi adalah biru (Keusch 2003).
Enzim amilase yang berada dalam air liur tetap berwarna bening ketika ditambahkan dengan Fenolftalein (FF). Warna bening yang dihasilkan dalam uji FF menandakan bahwa larutan bersifat asam. Hal ini menguatkan pernyataan bahwa air liur bersifat asam. Fenolftalein adalah indikator titrasi yang lain yang sering digunakan, dan fenolftalein ini merupakan bentuk asam lemah yang lain.
Pada kasus ini, asam lemah tidak berwarna dan ion-nya berwarna merah muda terang. Penambahan ion hidrogen berlebih menggeser posisi kesetimbangan ke arah kiri, dan mengubah indikator menjadi tak berwarna. Penambahan ion hidroksida menghilangkan ion hidrogen dari kesetimbangan yang mengarah ke kanan untuk menggantikannya - mengubah indikator menjadi merah muda. Range pH berkisar antara 8-10. Sifat asam air liur juga dibuktikan melalui percobaan Metil Oren (MO). Jingga metil adalah salah satu indikator yang banyak digunakan dalam titrasi. Pada larutan yang bersifat basa, jingga metil berwarna kuning dan strukturnya adalah:
Dari hasil percobaan, didapatkan bahwa air liur yang dicampurkan dengan MO menghasilkan warna oren (jingga) yang berarti larutan bersifat asam.
Hasil uji Biuret terhadap enzim amilase menunjukkan hasil yang positif dengan berubahnya warna larutan menjadi violet (tabel 1). Uji Biuret dilakukan untuk mengetahui keberadaan gugus amida pada larutan yang diuji. Menurut Raras et al (2010), reaksi Biuret menggunakan beberapa macam reagen, yaitu CuSO4 dan NaOH. CuSO4 berfungsi sebagai penyedia ion Cu2+ yang nantinya akan membentuk kompleks dengan protein. Sementara penambahan NaOH berfungsi untuk menyediakan basa. Suasana basa akan membantu membentuk Cu(OH)2 yang nantinya akan menjadi Cu2+ dan 2OH-. Reaksi yang terjadi pada pengujian Biuret adalah :
Hasil yang positif menunjukkan bahwa enzim amilase yang terkandung dalam air liur mengandung gugus amilase. Hasil positif pun didapatkan pada uji millon. Prinsip dari uji millon adalah pembentukan garam merkuri dari tirosin yang ternitrasi. Tirosin merupakan asam amino yang mempunyai molekul fenol pada gugus R-nya, yang akan membentuk garam merkuri dengan pereaksi millon. Pereaksi millon berisi merkuri dan ion merkuro dalam asam nitrat dan asam nitrit. Warna yang mengalami perubahan kekuningan merupakan garam merkuri dan tirosin yang ternitrasi. Sehingga pada air liur terdapat kandungan garam tirosin. Uji Molisch juga dilakukan pada pengujian sifat air liur. Prinsip uji Molisch adalah kondensasi dari hidroksi metal furfural (heksosa) atau furfural (pentosa) dengan alfa-naftol akan membentuk suatu cincin berwarna ungu. Alfa-naftol berfungsi sebagai indicator warna untuk memudahkan saja, sedangkan H2SO4 berfungsi untuk menghidrolisis glukosa (heksosa) menjadi hidroksimetil fufural atau arabinosa (pentosa) yang akan diubah menjadi furufural. Reaksi Molisch ini positif untuk semua karbohidrat. Hasil uji molish pada air liur menghasilkan perubahan warna campuran air liur dengan pereaksi molish menjadi violet. Perubahan warna menjadi violet menunjukkan reaksi positif yang berarti dalam air liur terkandung karbohidrat.
Uji klorida adalah uji untuk mendeteksi adanya kandungan ion klorida pada suatu larutan. Hasil uji klorida menunjukkan terdapat endapan putih yang menunjukkan reaksi positif pada uji ini. Uji klorida menunjukkan bahwa air liur mengandung ion klorida.
Uji Musin yang dilakukan pada air liur dihasilkan reaksi positif dengan terbentuknya endapan berwarna putih pada dasar tabung reaksi (gambar 3). Uji Musin menunjukkan bahwa air liur mengandung musin.
Uji fosfat merupakan uji untuk mengetahui adanya ion fosfat pada suatu larutan. Pada tabung reaksi setelah penambahan HNO3 pekat terdapat endapan kuning. Sebelumnya pada preparasi untuk uji fosfat dan kalsium asam asetat yang ditambahkan berfungsi untuk melarutkan endapan Ca-Mg-fosfat. Asam nitrat pekat yang ditambahkan berfungsi untuk melepaskan asam fosfat menjadi asam fosfat. Setelah penambahan ammonium molibdat, fosfat yang terlepas berikatan menjadi ammonium fosfomolibdat . Hasil uji fosfat bereaksi negatif dengan terbentuknya warna hijau kekuningan. Sehingga dalam saliva tidak mengandung ion fosfat (Gilvery 1996).
Uji sulfat pada air liur menunjukkan reaksi positif dengan terbentuknya endapan putih pada larutan yang diuji (gambar 5). Pengujian sulfat ini menggunakan BaCl2 yang akan membentuk BaSO4 yang memiliki kelarutan rendah sehingga akan mengakibatkan terbentuknya endapan dalam larutan yang diasamkan. Dalam hasil pengamatan terlihat endapan putih (lebih keruh). Hal ini membuktikan adanya ion sulfat di dalam air liur (saliva). Menurut Maryati (2000), ion-ion utama yang ditemukan dalam saliva adalah kalsium dan fosfat yang berperan penting dalam pembentukan kalkulus. Ion-ion lain yang memiliki jumlah yang lebih kecil terdiri dari sodium, potasium, klorida, sulfat dan ion-ion lainnya. Saliva terdiri atas 99.24% air dan 0.58% terdiri atas ion-ion Ca2+, Mg2+, Na+, K+, PO43-, Cl-, HCO3-, SO42-, dan zat-zat organik seperti musin dan enzim amilase (ptialin). Musin suatu glikoprotein dikeluarkan oleh kelenjar sublingual dan kelenjar submaksilar, sedangkan ptialin dikeluarkan oleh kelenjar parotid. Cairan air liur mengandung α-amilase yang menghidrolisa ikatan α(1→4) pada cabang sebelah luar glikogen dan amilopektin menjadi glukosa, sejumlah kecil maltosa, dan suatu inti tahan hidrolisa yang disebut dekstrin. Hanya sebagian kecil amilum yang dapat dicema di dalam mulut, oleh karena itu sebaiknya makanan dikunyah lebih lama untuk memberi kesempatan lebih banyak pemecahan amilum di rongga mulut.
Aktivitas enzim amilase dipengaruhi oleh beberapa faktor, diantaranya adalah perubahan pH, suhu, pelarut organik, dan yang menyebabkan denaturasi protein. Pengujian pengaruh suhu terhadap air liur digunakan dua pereaksi yang berbeda. Uji Yodium terhadap hasil percobaan pengaruh suhu aktivitas amilase air liur yang dipanaskan pada suhu 80oC dan 37oC memberikan hasil yang positif, yaitu larutan menjadi berwarna kuning dan kecokelatan. Hal tersebut menunjukkan pati dihidrolisis oleh amilase air liur. Campuran amilase air liur dan pati yang disimpan pada suhu 10oC, dan suhu kamar memberikan hasil yang negatif. Hal ini ditunjukkan dengan warna biru larutan. Warna ini disebabkan oleh belum terhidrolisisnya pati secara sempurna. Larutan iod berperan sebagai indikator hidrolisis. Senyawa polisakarida akan memberikan warna yang spesifik dengannya, yaitu berupa warna ungu kehitaman tetapi jika polisakarida tersebut dihidrolisis maka warna yang ditimbulkan adalah warna kuning kecokelatan (Maryati 2000). Sementara hasil uji Benedict menunjukkan campuran yang disimpan pada suhu 80oC menunjukkan reaksi negatif. Hal ini menunjukkan bahwa enzim amilase tidak bekerja pada suhu di atas 80oC. Pada suhu 37oC reaksi ini menimbulkan warna merah bata pada larutan. Hal tersebut dikarenakan glukosa yang dihidrolisis dari pati akan berikatan dengan pereaksi benedict membentuk kompleks berwarna merah bata (Poedjadi 1994). Berdasarkan hasil percobaan, dapat diketahui bahwa suhu optimum aktivitas enzim amilase adalah 37oC. Suhu optimum untuk aktivitas enzim amilase adalah 37oC (Ahmad 2000).
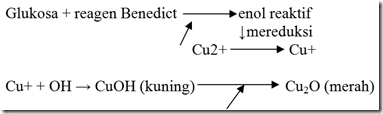
Uji benedict didapatkan hasil positif pada pemanasan suhu 10oC, 27oC (suhu kamar), dan 37oC. Sementara pada pemanasan 80oC didapatkan hasil negatif. Hal ini menunjukkan bahwa pada suhu 80oC, enzim amilase mengalami denaturasi. Sehingga pada suhu 80oC, glikogen tidak terdeteksi. Pati matang lebih cepat terhidrolisis dibanding dengan pati mentah, karena matang berarti pada suhu 100°C dan ikatan rantai sudah terputus-putus sehingga akan mudah terhidrolisis dan menimbulkan warna merah bata yang menunjukkan ada banyak kabohidrat yang terkandung (Simanjuntak & Silalahi 2003). Hal tersebut dikarenakan uji benedict merupakan uji untuk menguji kandungan gula pereduksi. reaksi dinyatakan positif apabila terbentuk endapan berwarna biru kehijauan sampai merah batu bata. (tergantung pada kadar gula reduksi yang tersedia). Sementara pada uji pada suhu 10oC, 27oC (suhu kamar), dan 37oC didapatkan hasil positif. Hal ini dikarenakan pada suhu tersebut, enzim masih bisa bertahan (tidak mengalami denaturasi), sehingga enzim dapat mengubah pati yang terlarut dalam air liur menjadi glikogen. Terbentuknya glikogen dibuktikan dengan uji positif terhadap benedict dengan munculnya endapan merah pada uji benedict. Uji benedict ini spesifik untuk karbohidrat yang mempunyai gugus karbonil bebas, yaitu semua monosakarida dan disakarida kecuali sukrosa dan trehalosa. Dasar reaksi ini yaitu adanya reduksi dan oksidasi. Dalam reagen terdapat CuSO4, Na-sitrat, dan Na2CO3. CuSO4 berfungsi untuk menyediakan Cu2+. Na-sitrat berfungsi untuk mencegah terjadinya endapan Cu(OH)2 atau CuCO3, sementara Na2CO3 berfungsi sebagai alkali yang mengubah gugus karbonil bebas dari gula menjadi bentuk enol yang reaktif. Enol yang reaktif mereduksi Cu2+ dari senyawa kompleks dengan sitrat menjadi Cu+. Cu+ bersama OH membentuk CuOH (berwarna kuning), yang dengan pemanasan akan berubah menjadi endapan Cu2O yang berwarna merah. Warna yang terbentuk bervariasi mulai dari hijau, kuning, orange, merah sampai endapan merah bata, tergantung jumlah Cu2O yang terbentuk, sehingga reaksi ini dapat digunakan untuk menentukan adanya gula baik secara kualitatif maupun kuantitatif.
KESIMPULAN
Saliva bersifat asam dengan hasil percobaan FF dan MO. Saliva mengandung ion-ion organik seperti sulfat, klorida, musin, tanpa mengandung fosfat. Selain itu saliva mengandung enzim amilase. Enzim amilase dapat bekerja baik dalam suhu antara 30- 40 ºC, yaitu suhu tubuh.
DAFTAR PUSTAKA
Ahmad H. 2000. Larutan Asam dan Basa. Bandung: Ganesa.
Amerongen AVN. 1991. Ludah dan Kelenjar Ludah : Arti Bagi Kesehatan Gigi. Surabaya : Gadjah Mada University Press.
Aisjah G. 1986. Enzim dalam Biokimia 1. Jakarta: Gramedia.
Gaman & Sherrington. 1992. Ilmu Pangan. Surabaya: Gadjah Mada University press.
Gilvery G. 1996. Biokimia Suatu Pendekatan Fungsional. Edisi 3. Airlangga University Press: Surabaya
Keusch P. 2003. Basic and acid Azo Dyes. USA: Chemie-uni.
Maryati S. 2000. Sistem Pencernaan Makanan. Jakarta: Erlangga.
Poedjaji A. 1994. Dasar-dasar Biokimia. Jakarta: Universitas Indonesia.
Raras HAA et al. 2010. Penetapan Kadar Protein Secara Biuret. Yogyakarta: Universitas Sanatha Dharma.
Simanjuntak MT, Silalahi J. Penuntun Praktikum Biokimia. Sumatera: USU Digital Library.
Suharso M. 1986. Enzim dalam Biokimia. Yogyakarta: Gadjah Mada University Press.
Wirahadikusumah M. 1977. Biokimia: Protein, Enzim, dan Asam Nukleat. Bandung : Penerbit ITB.

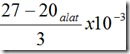


0 comments:
Posting Komentar