Pertumbuhan Mikroalga pada Beberapa Media
Minggu, 22 Januari 2012 | Ayun
Kurrataa’yun
G34090105
Biology, Bogor Agricultural University
Tujuan
Praktikum kali ini bertujuan untuk mengamati laju pertumbuhan mikroalga pada beberapa media dengan pH dan intensitas cahaya yang berbeda.
Pendahuluan
Mikroalga merupakan kelompok tumbuhan berukuran renik yang termasuk dalam kelas alga, diameternya antara 3-30 μm, baik sel tunggal maupun koloni yang hidup di seluruh wilayah perairan tawar maupun laut, yang lazim disebut fitoplankton. Di dunia mikrobia, mikroalga termasuk eukariotik, umumnya bersifat fotosintetik dengan pigmen fotosintetik hijau (klorofil), coklat (fikosantin), biru kehijauan (fikobilin), dan merah (fikoeritrin). Morfologi mikroalga berbentuk uniseluler atau multiseluler tetapi belum ada pembagian tugas yang jelas pada sel-sel komponennya. Hal itulah yang membedakan mikroalga dari tumbuhan tingkat tinggi (Romimohtarto, 2004). Menurut Wulamni (2010), parameter pertumbuhan fitoplankton mencakup pH, Salinitas, suhu, cahaya, karbondioksida, nutrient dan aerasi.
Isnansetyo dan Kurniastuty (1995), menyatakan bahwa terdapat empat kelompok mikroalga antara lain : diatom (Bacillariophyceae), alga hijau (Chlorophyceae), alga emas (Chrysophyceae) dan alga biru (Cyanophyceae). Penyebaran habitat mikroalga biasanya di air tawar (limpoplankton) dan air laut (haloplankton), sedangkan sebaran berdasarkan distribusi vertikal di perairan meliputi : plankton yang hidup di zona euphotik (ephiplankton), hidup di zona disphotik (mesoplankton), hidup di zona aphotik (bathyplankton) dan yang hidup di dasar perairan / bentik (hypoplankton) (Eryanto et.al, 2003).
Dalam biomassa mikroalga terkandung bahan-bahan penting yang sangat bermanfaat, misalnya protein, karbohidrat, lemak dan asam nukleat. Persentase keempat komponen tersebut bervariasi tergantung jenis alga. Sebagai contoh, mikroalga Chlorella vulgaris memiliki kandungan protein sebesar 51 – 58%, karbohidrat 12 - 17%, lemak 14 – 22% dan asam nukleat 4 – 5%. Spirulina platensis memiliki kandungan protein sebesar 46 – 43%, karbohidrat 8 – 14%, lemak 4 – 9%, dan asam nukleat 2 – 5% (Becker, 1994). Mikroalga lainnya seperti, Botryococcus braunii, Dunaliella salina, Monalanthus salina mempunyai kandungan lemak berkisar 40 - 85% (Borowitzka, 1998). Kandungan lemak. mikroalga tergantung dari jenis mikroalga, rata-rata pertumbuhan dan kondisi kultur mikroalga (Chisti, 2007). Sehingga, menurut Steenblock (2000), beberapa mikroalga seperti Chlorella memiliki potensi sebagai pakan alami, pakan ternak, suplemen, penghasil komponen bioaktif bahan farmasi dan kedokteran.
Hasil Pengamatan
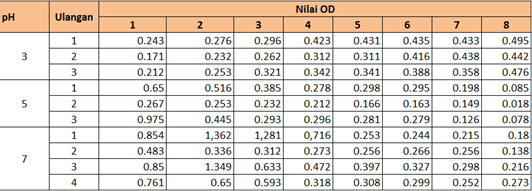
Tabel 1 Hasil pengukuran Optical Density (OD) mikroalga di Lab Bio 4.
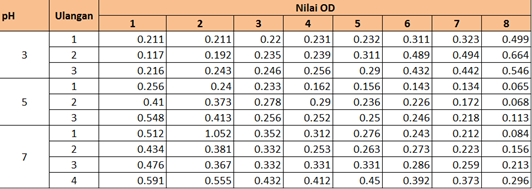
Tabel 2 Hasil pengukuran Optical Density (OD) mikroalga di Lab Bio 5.
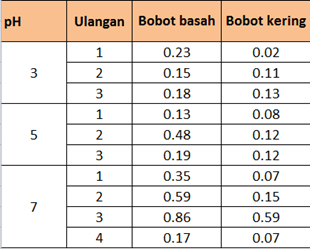
Tabel 3 Hasil pengukuran bobot kering dan bobot basah mikroalga di Lab bio 4.
Tabel 4 Hasil pengukuran bobot kering dan bobot basah mikroalga di Lab bio 5.
Pembahasan
Mikroalga yang digunakan merupakan mikroalga yang berasal dari danau Setu Burung. Warna biakan berwarna hijau tua. Sehingga, dapat diasumsikan bahwa mikroalga yang digunakan merupakan kelompok mikroalga dari Chlorophyceae. Menurut Campbell (2000), Chlorophyta (Alga hijau) dinamai berdasarkan kloroplasnya yang berwarna hijau rumput. Lebih dari 7000 spesies alga hijau telah diidentifikasi. Bentuk tubuh ada yang bulat, filament, lembaran, dan ada yang menyerupai tumbuahan tinggi.
Percobaan dilakukan dengan memberikan pH yang berbeda pada setiap biakan, yaitu pH 3, 5, dan 7. Untuk pH 3 dan pH 5 terdapat tiga kali ulangan. Sementara pH 7 dilakukan 4 kali ulangan. Perbedaan perlakuan yang dilakukan antara lab bio4 dan lab bio 5 adalah, pemberian intensitas cahaya dimana lab bio 4 diberikan intensitas cahaya sebesar 10.000 lux sementara lab bio 5 hanya dengan intensitas cahaya 7.000 lux. Pengamatan dilakukan selama 16 hari dengan jangka waktu setiap dua hari sekali yaitu dengan mengukur optical density nya menggunakan spektrofotometri. Hasil pengamatan didapatkan data bahwa alga yang diberikan perlakuan pada pH 5 dan 7 mengalami penurunan nilai OD (Optical density). Hal ini mengindikasikan bahwa pertumbuhan pada media biakan pH 5 dan 7 mengalami peningkatan. Menurut Tarigan( 2008). Spektofotometri adalah suatu instrument untuk menukur transmitas atau absorbans suatu contoh sebagai fungsi panjang gelombang. Nilai Optical density berbanding terbalik dengan kerapatan mikroalga.
Sementara untuk pH 3, OD yang terukur relatif mengalami penurunan setiap harinya. Sehingga diketahui bahwa mikroalga yang terkandung dalam air biakan semakin jarang. Hal ini juga terlihat dari warna airnya yang semakin bersih. Dari data tersebut diketahui bahwa mikroalga mengalami laju pertumbuhan negatif pada pH asam, dalam hal ini pH 3. Sementara pada pH 5 dan 7 terjadi peningkatan laju pertumbuhan. Hal ini sesuai dengan pernyataan Natasya (2009) yang mengatakan bahwa Derajat keasaman (pH) media menentukan kelarutan dan ketersediaan ion mineral sehingga mempengaruhi penyerapan nutrien oleh sel. Perubahan nilai pH yang drastis dapat mempengaruhi kerja enzim serta dapat menghambat proses fotosintesis dan pertumbuhan beberapa mikroalga. Menurut Cotteau (1996) dan Taw (1990), Derajat keasaman atau pH digambarkan sebagai keberadaan ion hidrogen. Variasi pH pada dapat mempengaruhi metabiolisme dan pertumbuhan kultur mikroalga antara lain mengubah keseimbangan karbon anorganik, mengubah ketersediaan nutrien dan mempengaruhi fisiologi sel. Kisaran pH untuk kultur alga biasanya antara 7-9, kisaran optimum untuk alga laut antara 7.5-8.5 sedangkan untuk Tetraselmis chuii optimal pada 7-8.
Pertumbuhan mikroalga pada intensitas cahaya 10.000 lux (lab bio 4) relatif lebih rendah dibandingkan dengan pertumbuhan mikroalga pada intensitas cahaaya 7.000 lux (lab bio 5), terlihat dari bobot akhirnya dan nilai ODnya. Hal ini dapat diakibatkan karena intensitas cahaya yang berlebihan dapat menggangu produktivitas dan pertumbuhannya. Menurut Mujiman (2004) Intensitas cahaya sangat menentukan pertumbuhan mikroalga yaitu dilihat dari lama penyinaran dan panjang gelombang yang digunakan untuk fotosintesis. Cahaya berperan penting dalam pertumbuhan mikroalga, tetapi kebutuhannya bervariasi yang disesuaikan dengan kedalaman kultur dan kepadatannya. Cahaya merupakan sumber energi dalam proses fotosintetis yang berguna untuk pembentukan senyawa karbon organic. Kebutuhan akan cahaya bervariasi tergantung kedalaman kultur dan kepadatannya. Intensitas cahaya yang terlalu tinggi dapat menyebabkan fotoinbihisi dan pemanasan. Intensitas cahaya 1000 lux cocok untuk kultur dalam Erlenmeyer, sedangkan intensitas 5000-10000 lux untuk volume yang lebih besar.
Walaupun nilai OD cenderung meningkat pada pH 5 dan 7, serta menurun pada pH 3, tetapi masih ada beberapa data yang terlihat mengalami penyimpangan. Hal ini dapat diakibatkan adanya kesalahan saat pengukuran. OD yang cenderung lebih rendah ketika seharusnya meningkat dapat diakibatkan tidak dilakukan pengocokan sebelum pengukuran. Sehingga mikroalga tidak tersebar merata. Selain itu, kesalahan saat menggunakan spektofotometri dapat menjadi faktor kesalahan.
Kesimpulan
Pertumbuhan mikroalga dipengaruhi oleh pH, Salinitas, suhu, cahaya, karbondioksida, nutrient dan aerasi. Pada pengamatan tingkat pH, mikroalga dapat mengalami laju pertumbuhan tinggi pada pH 5 – 7. Namun lebih optimum pada pH 7. Sementara pada pH rendah, terjadi laju pertumbuhan negatif. Intensitas cahaya yang mengalami pertumbuhan lebih tinggi terjadi pada biakan dengan penyinaran 7000 lux. Sementara pada intensitas cahaya 10.000 lux, mikroalga mengalami fotoinhibisi.
Daftar Pustaka
Becker EW. 1994. Microalgae Biotechnology and Microbiology. New York: Cambridge University Press.
Borowitzka MA. 1998. Microalgae Biotechnology. New York : Cambridge University Press.
Campbell AN. 2000. Biologi Jilid I, 5th edition. Jakarta: Erlangga.
Chrismadha T, Nofdianto, Rosidah Y. 1998. Hasil Penelitian dan Pengembangan Limnologi. Cibinong : Pusat Penelitian dan Pengembangan Limnologi LIPI.
Christi Y. 2007. Biodiesel From Microalgae. Biotechnology Advances(25):294–306.
Cotteau P. 1996. Microalgae. In: Manual on Production and Use of Live Food for Aquaculture. FAO Fisheries Technical Paper. Roma: Sorgeloos Edition.
Eryanto A et al. 2003. Suatu Pendekatan Biologi dan Manajemen Plankton dalam Budidaya Udang. Surabaya : PT. CPB.
Isnansetyo A, Kurniastuti. 1995. Pakan Alami untuk Pembenihan Organisme Laut. Yogyakarta :Penerbit Kanisius
Mudjiman A. 2004. Makanan Ikan Edisi Revisi. Jakarta: Penebar Swadaya.
Natasya GY. 2009. Pengaruh Sedimen Berminyak Terhadap Pertumbuhan Mikroalga Isochrysis Sp. Bogor : IPB Press.
Reynolds CS. 1984. The Ecology of Freshwater Phytoplankton. New York: Cambridge University Press
Romimohtarto K. 2004. Meroplankton Laut : Larva Hewan Laut yang Menjadi Plankton. Jakarta : Djambatan.
Steenblock D. 2000. Chlorella: Makanan Sehat Alami. Jakarta: Gramedia Pustaka.
Tarigan IM. 2008. Analisis Penggunaan Kitosan dan Kitosan Manik Sebagai Adsorben untuk Menurunkan Kadar Larutan Standar Besi (Fe) dan Aluminium (Al) dengan Metode Spektrofotometri Serapan Atom. Medan : Universitas Sumatera Utara
Wulamni. 2010. Budidaya Pakan Alami Mikroalga dari Skala Lab. Kendari : Universitas Haluoleo

2 comments:
terimakasih tulisannya mbk....
saran klo bisa pengaruh parameter pertumbuhannya d'perjelas dengan lengkap...
Mbak boleh share bagaimana cara pengukuran lipid pada mikroalga?
Terima kasih sebelumnya ya. Jazakallah.
salam,
Posting Komentar